如何运行分析
Seahorse XF 分析学习中心


顶部
实现成功分析所需的实验流程、技术与资源
本学习中心旨在向您介绍 Seahorse XF 分析工作流程,重点介绍实验流程与技术,确保获得出色的 XF 分析性能与结果。在您阅读每一部分时,流程是指使用安捷伦 Seahorse XF 实时 ATP 速率测定细胞能量代谢表型测试进行初始细胞表征。所述的技术适用于所有 Seahorse XF 分析,如接种贴壁细胞、加药口上样等。只有必需消耗品根据 XF 分析仪型号和 XF 检测试剂盒的不同而有所不同。使用下拉菜单选择您的 XF 分析仪,然后单击以下部分即可显示 XF 分析工作流程相应步骤的相关内容。
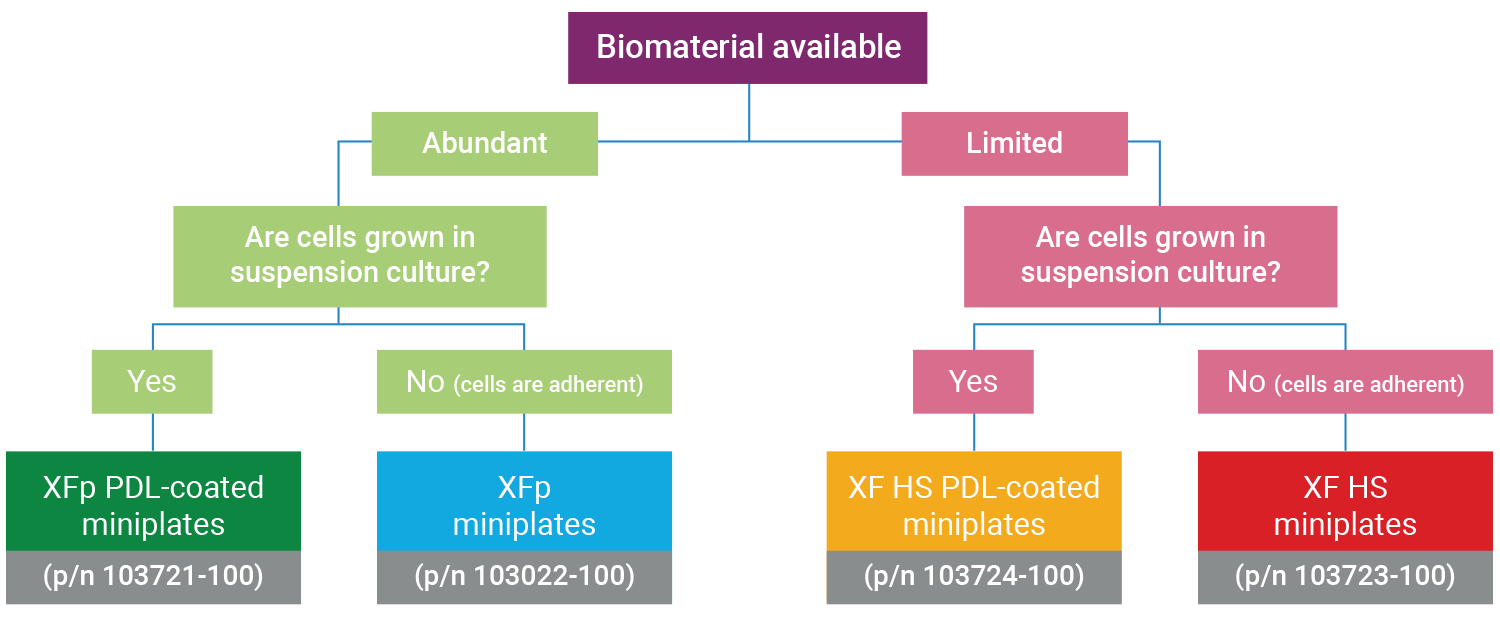
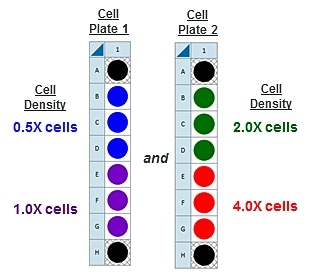
注:XF HS Mini 分析仪兼容标准 XFp 迷你板、XFp PDL 迷你板、XF HS 迷你板和 XF HS PDL 迷你板。设计 XF HS 迷你板和 XF HS PDL 迷你板的目的是每孔可使用更少细胞进行 XF 分析,以便对非增殖细胞或数量有限的细胞进行功能分析。
XFp 迷你板和 XF HS 迷你板都包含一块 8 孔细胞培养板,但 XF HS 迷你板的不同之处在于,在每个孔的中心有一个凸起的“环状”元件。这意味着每孔的接种面积为 0.031 cm2,约为标准 XFp 细胞培养板的 30%。XF HS 迷你板还预装有硅胶细胞接种遮罩和板盖。每包 XF HS 迷你板都配有一个遮罩拆卸工具。
注:建议对 XF HS 迷你板和 XFp 迷你板均进行细胞密度优化。
1. 准备实验材料
这部分列出了设置 XF 分析所需的材料。
这部分列出了设置 XF 分析所需的材料。
注:所有 XFp 检测试剂盒和消耗品均与 XF HS Mini 分析仪兼容。
1.1 安捷伦提供的必需材料
- 带控制器的安捷伦 Seahorse XF Pro 分析仪
- 安捷伦 Seahorse 分析仪
- 安捷伦 Seahorse FluxPaks
- 安捷伦 Seahorse FluxPak
- 安捷伦 Seahorse FluxPak
- 安捷伦 Seahorse XFp 或 XFp PDL FluxPak
- 安捷伦 Seahorse XFp、XFp PDL、XF HS 或 XF HS PDL Mini FluxPak
- 合适的 XF 检测试剂盒
- 合适的 XFp 检测试剂盒
- 合适的 XF 检测液
- Seahorse XF DMEM 检测液,pH 7.4,或 Seahorse XF RPMI 检测液,pH 7.4
- Seahorse XF 葡萄糖(1.0 M 溶液)
- Seahorse XF 丙酮酸钠(100 mM 溶液)
- Seahorse XF 谷氨酰胺(200 mM 溶液)
为您的 XF HS Mini 实验选择合适的迷你板
XF HS Mini 分析仪兼容所有 Seahorse XFp 试剂盒、试剂、细胞培养板和 FluxPak。
相关支持材料
- 培训网络研讨会:准备实验材料
- 安捷伦 Seahorse XF 塑料耗材产品样本
- 安捷伦 Seahorse XF 检测试剂盒与试剂
- 消耗品指南
- 消耗品指南
- 消耗品指南
- 消耗品指南
- 消耗品指南
- 消耗品指南
- Seahorse XF 培养基和缓冲液选择指南
- 制备 XF 检测液
- 制备 XF 检测液
- 细胞表征:XFe96/XF96 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XFe24 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XFp 分析仪和 Seahorse XFp 实时 ATP 速率测定
- 细胞表征:XF HS Mini 分析仪和 XF 实时 ATP 速率测定
- 细胞表征:采用 XF HS Mini 分析仪、HS 迷你板进行 XF 实时 ATP 速率测定
参考资料
1.2 用户提供的其他必需材料
其他必需材料
- 37 °C 无 CO2 培养箱
- 细胞计数器/血细胞计数器
- 37 °C 水浴
- 蒸馏水或无菌 H2O
- 倒置明视场显微镜
- 接触式涡旋混合仪
- 15 和 50 mL 锥形管
- P200、P1000、8 通道和/或 12 通道 P200 移液器
- P200、P1000、8 通道 P200 移液器
- 试剂槽
推荐材料
- 使用细胞培养板适配器(使用悬浮细胞时需要)进行离心
- 微量离心管
- 已校准的 pH 计*
- 搅拌盘*
- 无菌滤瓶(0.22 µm 滤膜)和盖子*
- 1.0 N NaOH 溶液*
(*如使用 Seahorse XF DMEM pH 7.4 或 Seahorse XF RPMI pH 7.4 以外的检测液,则需要这些物品)
相关支持材料
- 培训网络研讨会:准备实验材料
- Seahorse XF 探针板和组织培养微孔板
- Seahorse XF 检测试剂盒与试剂
- 消耗品指南
- 消耗品指南
- 消耗品指南
- 消耗品指南
- Seahorse XF HS Mini 消耗品订购指南
- Seahorse XF 培养基和缓冲液选择指南
- 制备 XF 检测液
- 制备 XF 检测液
- 细胞表征:XFe96/XF96 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XFe24 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XFp 分析仪和 Seahorse XFp 实时 ATP 速率测定
- 细胞表征:XF HS Mini 分析仪和 XF 实时 ATP 速率测定
- 细胞表征:采用 XF HS Mini 分析仪、HS 迷你板进行 XF 实时 ATP 速率测定
参考资料
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 模板
- 安捷伦细胞分析出版物数据库
浏览使用安捷伦细胞分析数据的出版物的完整列表。

仅显示 Seahorse Seahorse XF Pro 的信息
更改仪器类型2. 准备进行 XF 分析
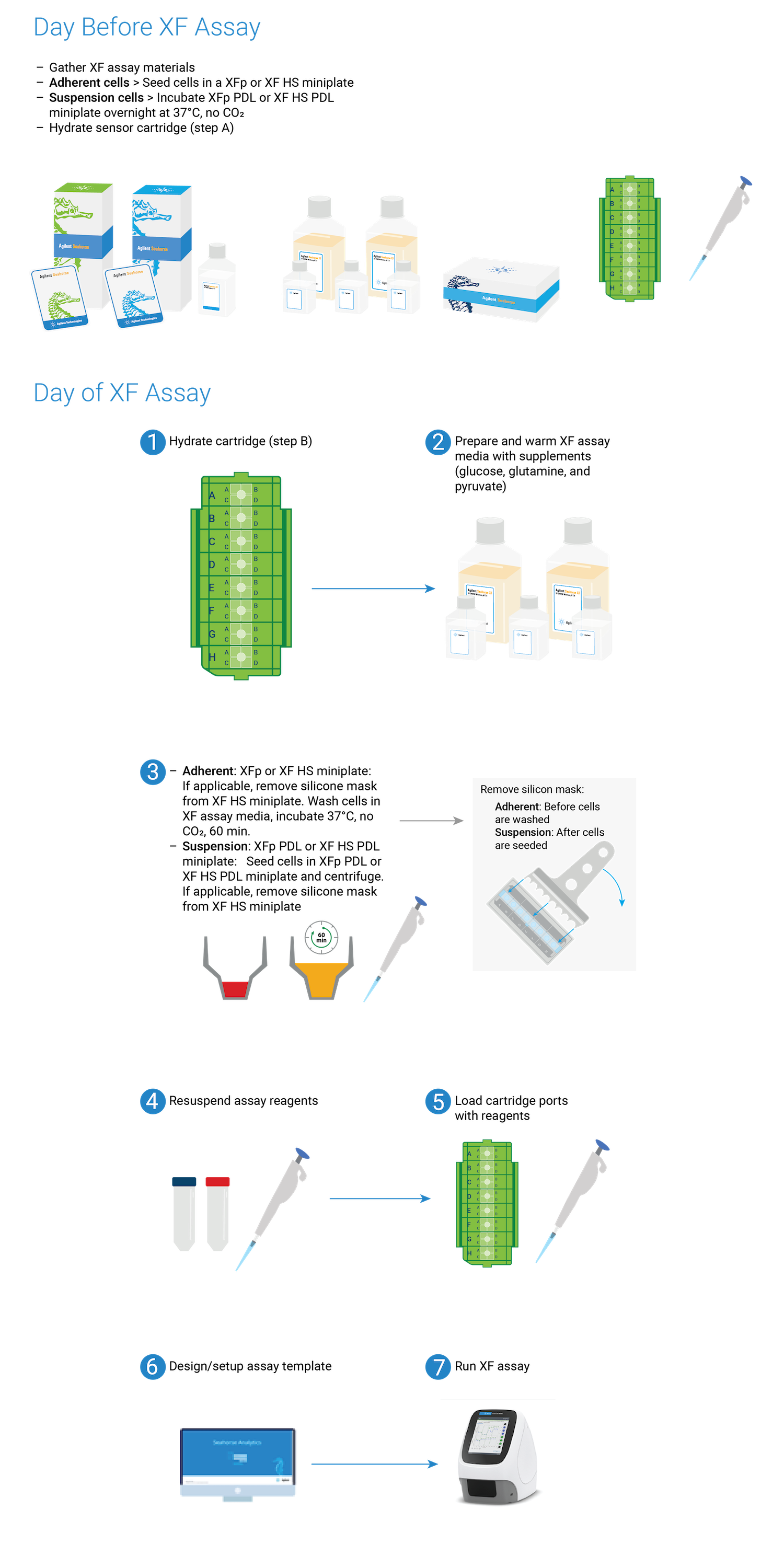
本部分重点介绍 XF 分析前一天的制备技术,包括细胞接种密度选择指导、XF 组织培养板上的贴壁细胞接种技术,以及 XF 探针板水化技术。
本部分重点介绍分析前一天的制备技术,包括细胞接种密度选择指导、XFp 组织培养板上的贴壁细胞接种技术,以及 XFp 探针板水化技术。
本部分重点介绍分析前一天的制备技术,包括细胞接种密度选择指导、XFp 迷你板、XF HS 迷你板或 XF HS PDL 迷你板上的贴壁细胞接种技术以及 8 孔探针板水化技术。
注:查看工作流程示意图,了解运行 XF HS Mini 实验所涉及的步骤。
选择工作流程步骤以显示帮助内容。
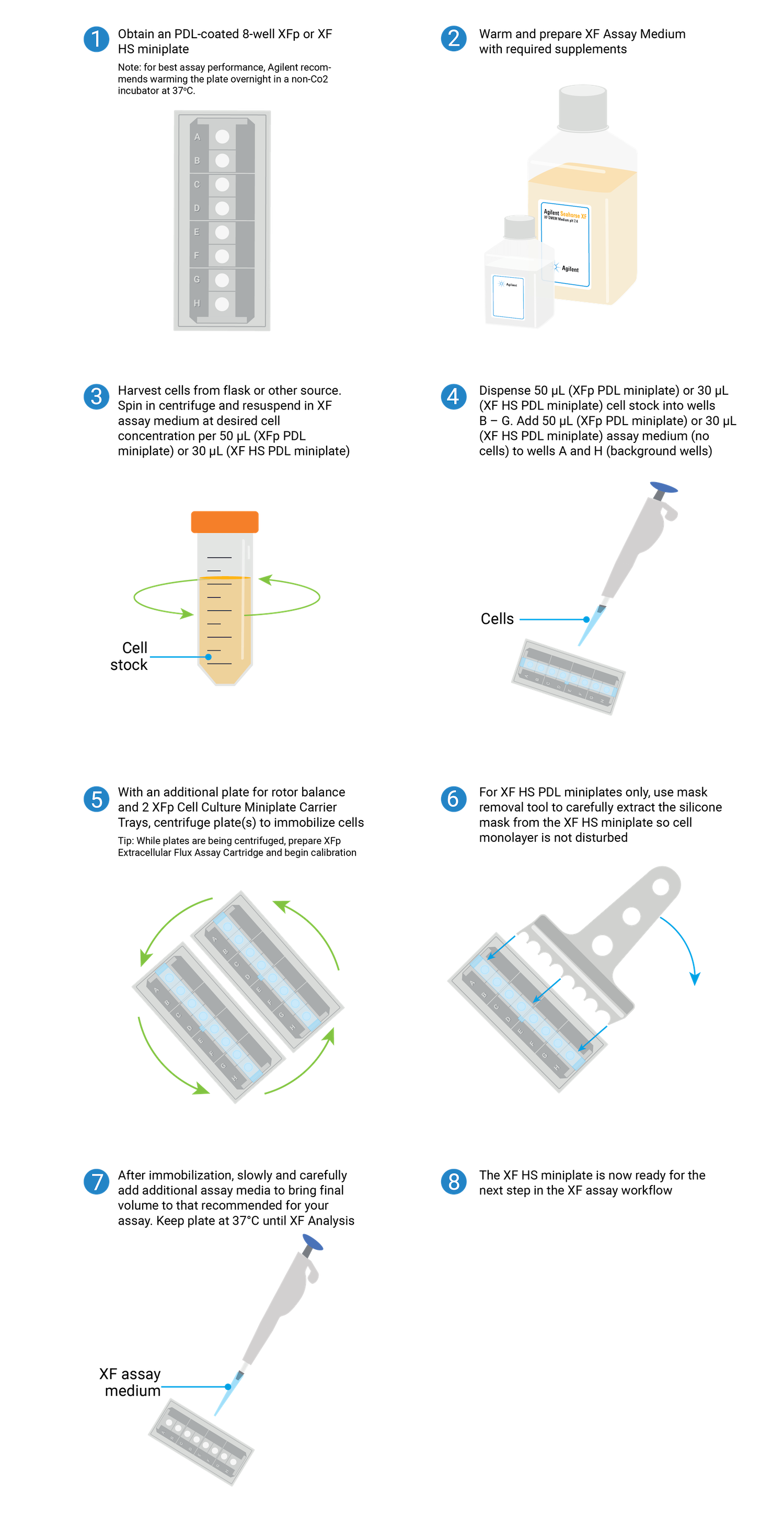
2.5 准备 XFp PDL 或 XF HS PDL 迷你板(仅适用于悬浮细胞)
使用 XFp 或 XF HS 迷你板进行实验的概述。
2.1 选择细胞接种密度
选择细胞接种密度的基本流程
为使用安捷伦 Seahorse 细胞能量代谢分析仪分析仪有效检测代谢和生物能量代谢功能,首先需要根据细胞在基础呼吸和最大呼吸 (OCR) 以及细胞外酸化 (ECAR) 条件下的代谢活动,表征特定的细胞类型。Seahorse XF 实时 ATP 速率测定试剂盒Seahorse XFp 实时 ATP 速率测定试剂盒可以通过一次实验两次小实验表征目标细胞系/细胞类型。
不同类型细胞的最佳细胞接种数量不同,但对于贴壁细胞通常介于 5 × 103 至 4 × 104 细胞/孔之间。悬浮细胞需要更高的接种密度,从 5 × 104 至 2 × 105 细胞/孔,具体取决于细胞类型。1 × 104 至 8 × 104 细胞/孔之间。通常,可使融合度达到 50%–90% 的密度即可获得仪器理想/动态范围内的代谢率。
不同类型细胞和孔板的最佳细胞接种数量不同。通常,可使融合度达到 50%–90% 的密度即可获得仪器理想/动态范围内的代谢率,详见下表。
对于 XF HS 迷你板和 XF HS PDL 迷你板,贴壁细胞的最佳接种数量通常介于 1.0 × 103 至 1.0 × 104 细胞/孔之间。悬浮细胞需要更高的接种密度,从 2.0 × 104 至 7.0 × 104 细胞/孔,具体取决于细胞类型。
对于 XFp 迷你板和 XFp PDL 迷你板,贴壁细胞的最佳接种数量通常介于 5 × 103 至 4 × 104 细胞/孔之间。悬浮细胞需要更高的接种密度,从 5 × 104 至 2 × 105 细胞/孔,具体取决于细胞类型。
请参阅安捷伦细胞分析出版物数据库,了解满足您特定需求的起始细胞密度。
请参阅安捷伦细胞分析出版物数据库,了解满足您特定需求的起始细胞密度。
| 孔板类型 | 最佳细胞接种数量(细胞/孔) | |
|---|---|---|
| 贴壁细胞 | 悬浮细胞 | |
| XF HS 迷你板/XF HS PDL 迷你板 | 1.0 × 103 – 1.0 × 104 | 2.0 × 104 – 7.0 × 104 |
| XFp 迷你板/XFp PDL 迷你板 | 5 × 103 – 4 × 104 | 5 × 104 – 2 × 105 |
选择细胞接种密度的基本流程
为使用安捷伦 Seahorse 细胞能量代谢分析仪有效检测代谢和生物能量代谢功能,首先需要根据细胞在基础呼吸和最大呼吸 (OCR) 以及细胞外酸化 (ECAR) 条件下的代谢活动,表征特定的细胞类型。Seahorse 细胞能量代谢表型测试试剂盒可以通过两次小实验表征目标细胞系/细胞类型
不同类型细胞的最佳细胞接种数量不同,但通常介于 1 × 104 至 8 × 104 细胞/孔之间。通常,可使融合度达到 50%–90% 的密度即可获得仪器理想/动态范围内的代谢率。
请参阅安捷伦细胞分析出版物数据库,了解满足您特定需求的起始细胞密度。
相关支持材料
- 准备进行 XF 分析
- 了解您感兴趣的细胞:获得成功的 XF 分析的建议
- 细胞能量代谢表型测试简介
- 细胞表征:XFe96/XF96 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XFe24 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XF24 分析仪和细胞能量代谢表型测试
- 细胞表征:XFp 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XF HS Mini 分析仪和 XF 实时 ATP 速率测定
- 细胞表征:采用 XF HS Mini 分析仪、HS 迷你板进行 XF 实时 ATP 速率测定
- Seahorse XF 实时 ATP 速率测定用户指南
- 技术概述:表征细胞 — 采用 OCR 值确定最佳接种密度
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 模板
- 安捷伦细胞分析出版物数据库
浏览使用安捷伦细胞分析数据的出版物的完整列表。
2.2 水化探针板
水化 8 孔传感器探针板的基本流程
注:XFp 探针板与 XF HS Mini 分析仪兼容
传感器探针板是 XFp HS Mini 分析平台的重要组成部分。传感器探针板的每个探针尖均布满固态传感器材料,可通过检测 pH 和 O2 浓度数据的变化来计算代谢速率。为使传感器能够正常工作,必须对其进行充分水化处理。
在进行 XFp HS Mini 分析前一天:
- 将至少 20 mL XF 校准液加入 50 mL 锥形管中。将其放置在无 CO2 培养箱中,37 °C 下培养过夜。
- 将至少 5 mL XF 校准液加入 15 mL 锥形管中。将其放置在无 CO2 培养箱中,37 °C 下培养过夜。
- 打开细胞能量代谢分析试剂盒,取出其中的内容物。
- 从绿色盒子中取出 3 包探针板。揭下密封箔,待用。
- 将探针板倒置于水化板旁边。
- 将水化板与探针板分开,并将探针板倒置于水化板旁边。
- 向水化板的每个孔中加入 200 µL 组织培养级无菌水。
- 向孔周围的每个水槽填充 400 µL。
- 将探针板置于水化板上,使探针浸入水中。
- 确定水位足够高,可使探针保持浸没状态。
- 将其放入无 CO2 培养箱中 37 °C 过夜。为防止水蒸发,请确保培养箱已适当加湿。
- 学习中心的第 3.1 节将继续介绍探针板水化方案,请继续阅读
- 打开 Seahorse XFe96/XF Pro 细胞外流量分析试剂盒并取出其中的内容物。
- 将探针板倒置于水化板旁边。
- 向水化板的每个孔中加入 200 µL XF 校准液。
- 将 XF 水化辅助板置于水化板顶部,并向下按压 XF 水化辅助板,确保与水化板紧密组装。
- 将探针板透过 XF 水化辅助板的开口置于水化板上,使探针浸入 XF 校准液中。
- 确定 XF 校准液面高度能否使探针保持浸没状态。
- 将其放入无 CO2 培养箱中 37 °C 过夜。为防止 XF 校准液蒸发,培养箱应适当加湿。
- 学习中心的第 3.1 节将继续介绍探针板水化方案,请继续阅读

- 打开安捷伦 Seahorse 能量代谢分析试剂盒,取出其中的内容物。
- 将探针板倒置于水化板旁边。
- 向水化板的每个孔中加入 1 mL XF 校准液。
- 将水化辅助板放置在水化板顶部。
- 将探针板透过水化辅助板的开口置于水化板上,使探针浸入 XF 校准液中。
- 将探针板置于水化板上,使探针浸入水中。
- 确定 XF 校准液位足够高,可使探针保持浸没状态。
- 将其放入无 CO2 培养箱中 37 °C 过夜。为防止 XF 校准液蒸发,培养箱应适当加湿。
- 重要说明:在将探针板放入安捷伦 Seahorse 分析仪之前,必须先取下水化辅助板。否则可能会对探针板和分析仪造成损害。参阅第 3 部分的进一步说明。
相关支持材料
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 模板
- 安捷伦细胞分析出版物数据库
浏览使用安捷伦细胞分析数据的出版物的完整列表。
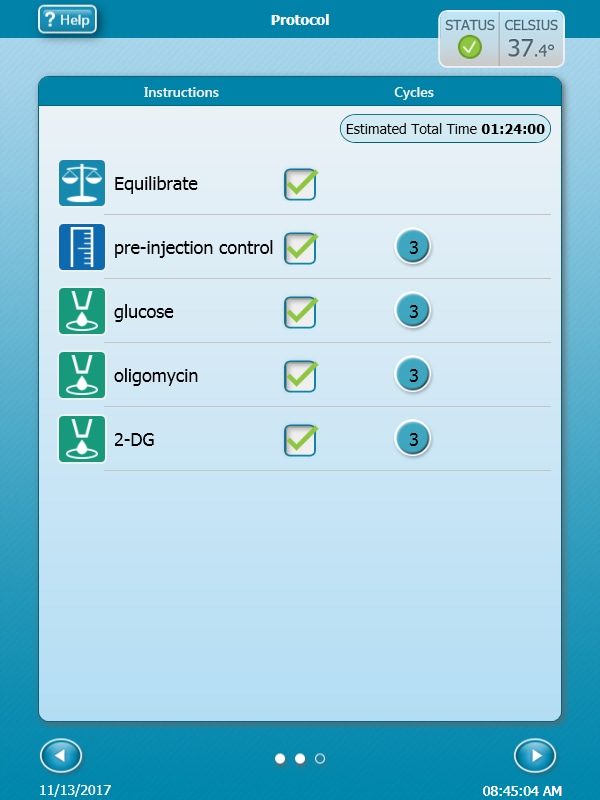
2.3 设计实验
Wave Pro、XF Pro 控制器和 Seahorse Analytics 软件均支持轻松创建和自定义检测模板文件,以便在 Seahorse XF Pro 分析仪上运行。XF Pro 控制器的使用说明如下。
在所有 Seahorse 分析仪上运行检测时均需要使用检测模板文件,并且必须在运行检测之前创建该文件。将检测模板文件视为您在实验室笔记本上所设计的实验的电子版本。这些模板可根据需要重复使用、与其他用户共享、复制或通过修改以创建用于其他 XF 分析的新检测模板。
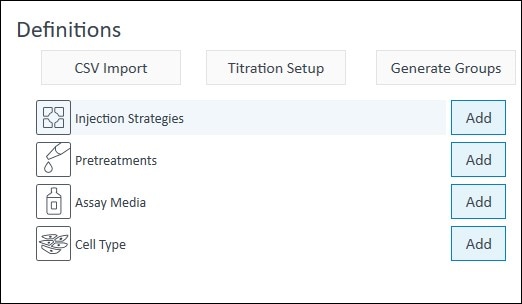
检测模板文件的 3 个元素是:
- 组定义
- 板布局
- 仪器方案
组定义
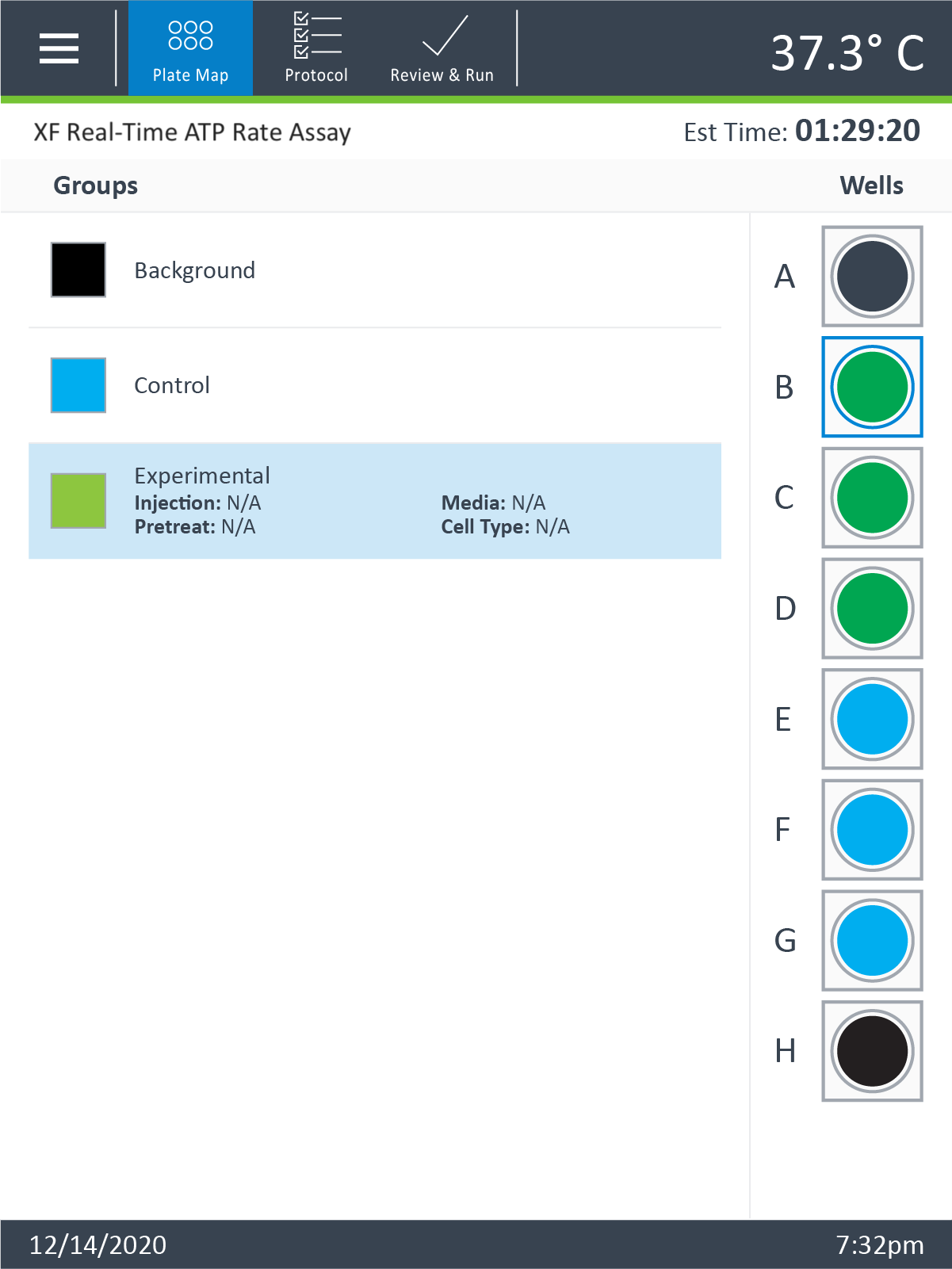
- 打开软件
- 单击 Templates(模板)
- 打开名为 XF Real-Time ATP Rate Assay(XF 实时 ATP 速率测定)的检测模板
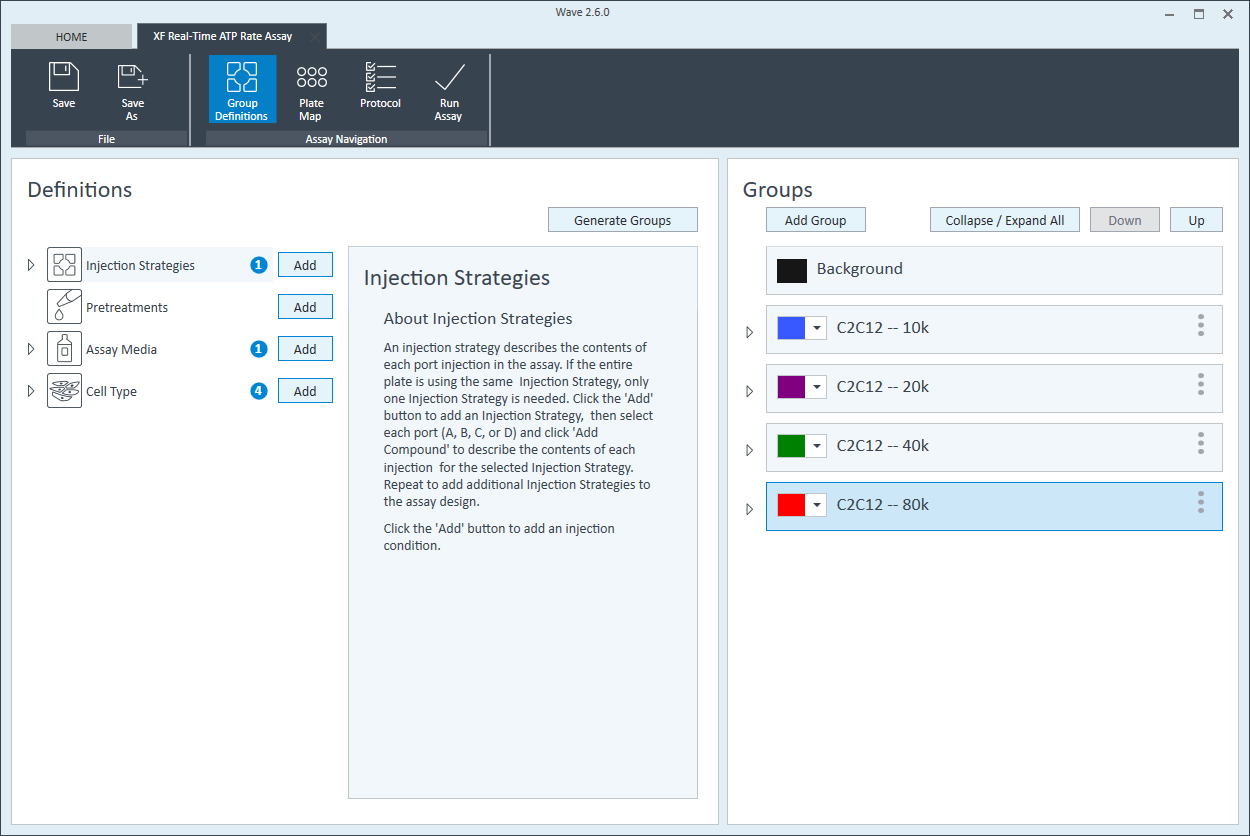
- 在 Group Definitions(组定义)视图中,您将看到加样策略、预处理、检测液和细胞类型的预添加信息。
- 双击 Pretreatments(预处理)并删除 Control & Experimental(对照与实验)条目。
- 双击 Cell Type(细胞类型)并 delete(删除)名为“细胞”的默认条目。
- 在 Cell Type(细胞类型)组定义中,单击 Cell Type(细胞类型)和 Add(添加)来添加新的细胞类型条目,并输入要分析的细胞类型的名称。建议将接种密度添加到组名称中。例如,C2C12 细胞类型每孔接种密度为 20000 个细胞,则命名为:20k C2C12
每个细胞类型定义重复 3 次。
注意:由于 XFe24 分析仪采用 24 孔微孔板形式,该细胞接种密度优化方案可以使用具有 4 种细胞接种密度的 1 块细胞板执行(每组 n = 5)。由于分析仪采用 96 孔微孔板形式,该细胞接种密度优化方案可以使用具有 4 种细胞接种密度的 1 块细胞板执行(每组 n = 22-24)。由于分析仪采用 8 孔迷你微孔板形式,该细胞接种密度优化方案必须使用每板具有 2 种细胞接种密度的 2 块细胞板执行(每组 n = 3)。在设计检测模板时,您可以:- 为第 3 和第 4 细胞接种密度组创建新的检测模板。
- 将 4 个细胞接种密度组添加到一个检测模板中,并在用细胞接种密度组 1 和 2 进行第一次测定后将第 3 和第 4 个细胞组重新分配到板布局。
- 在用细胞接种密度组 1 和 2 进行第一次测定后,重新命名该模板中的组。
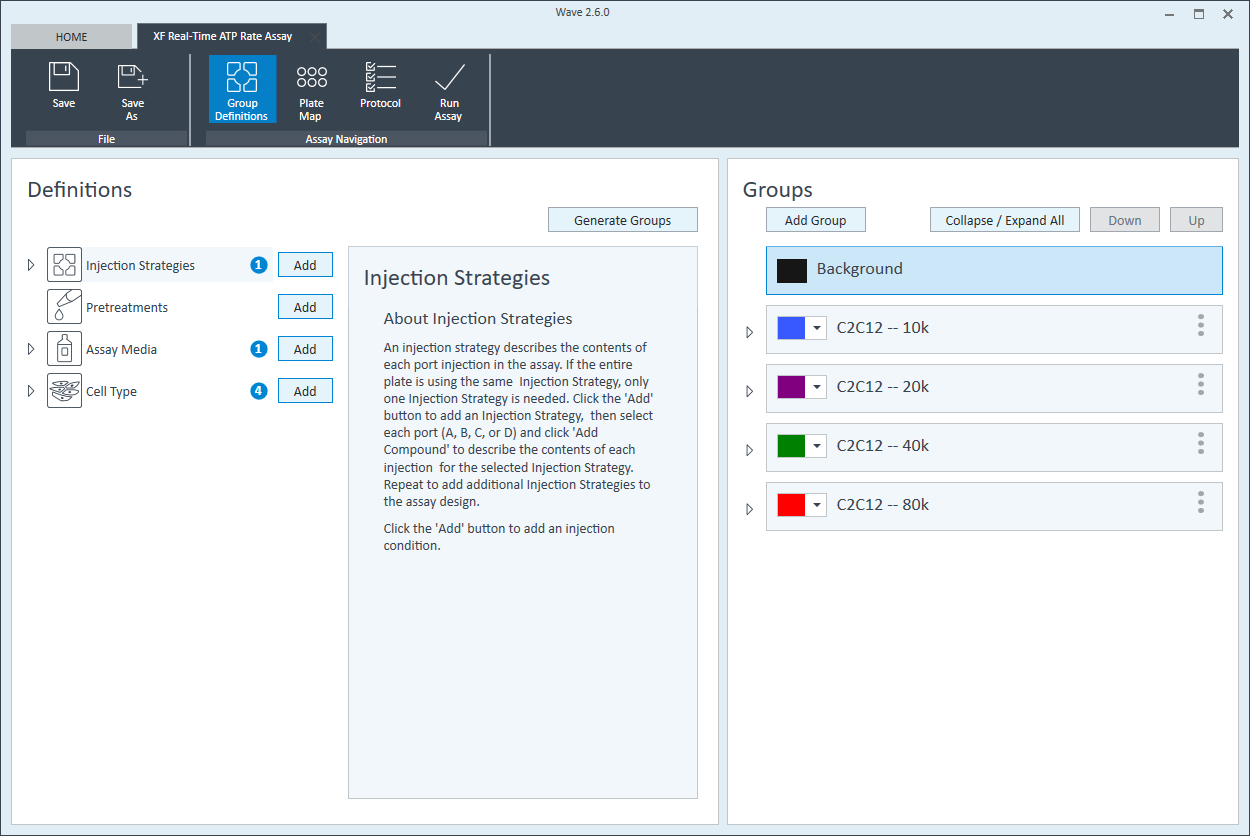
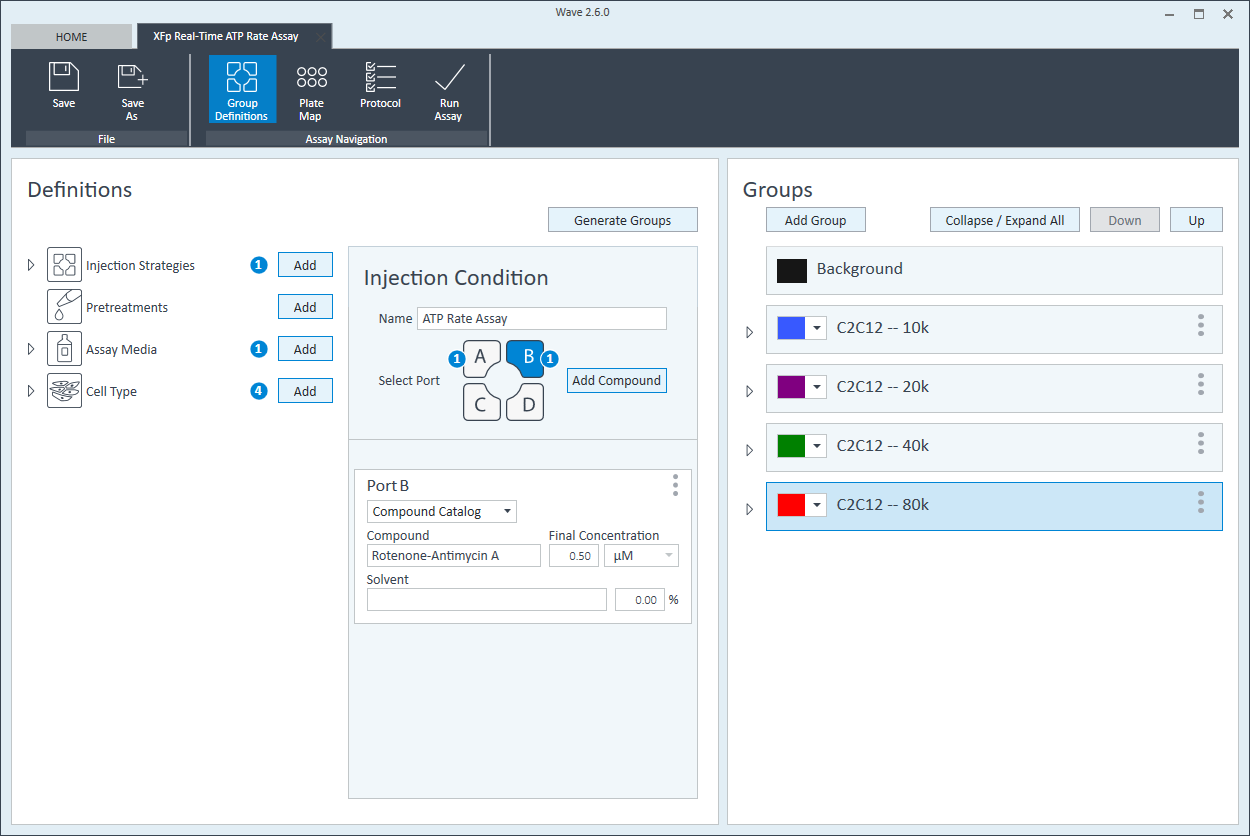
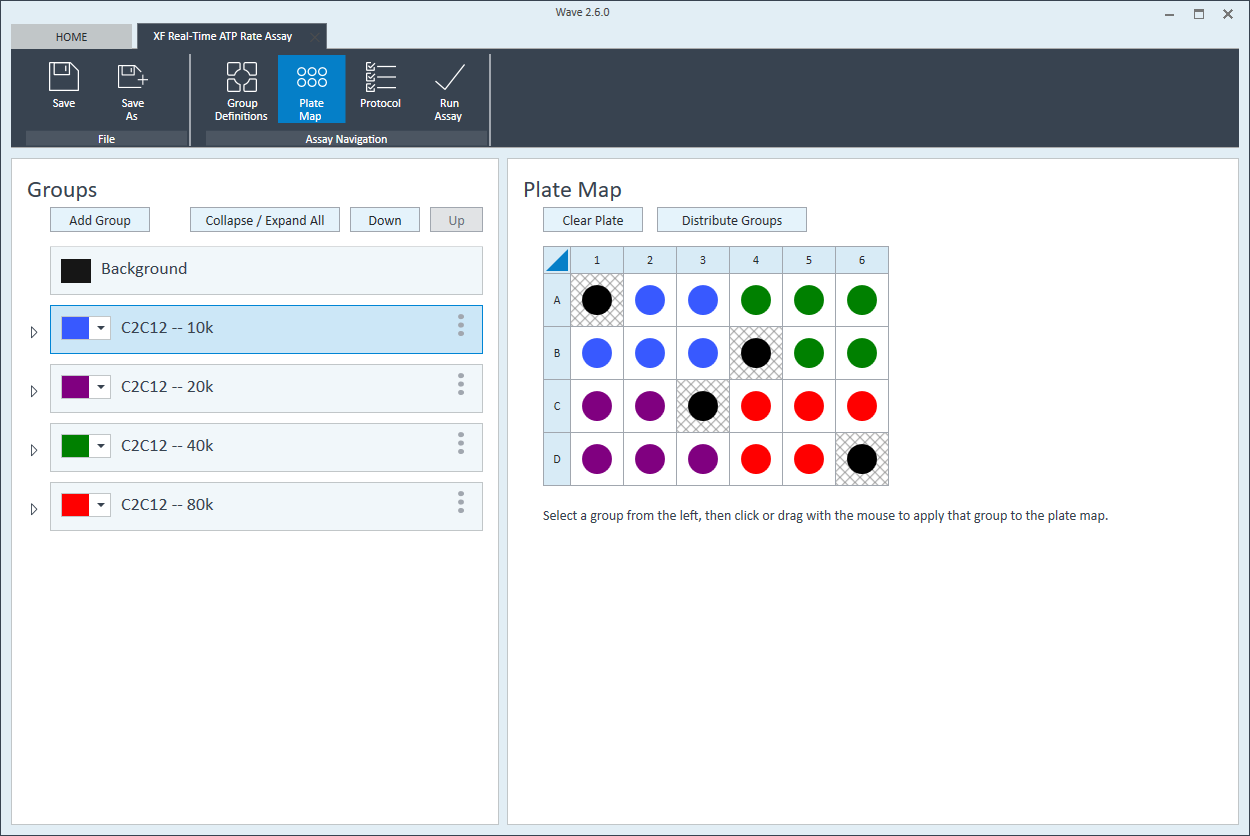
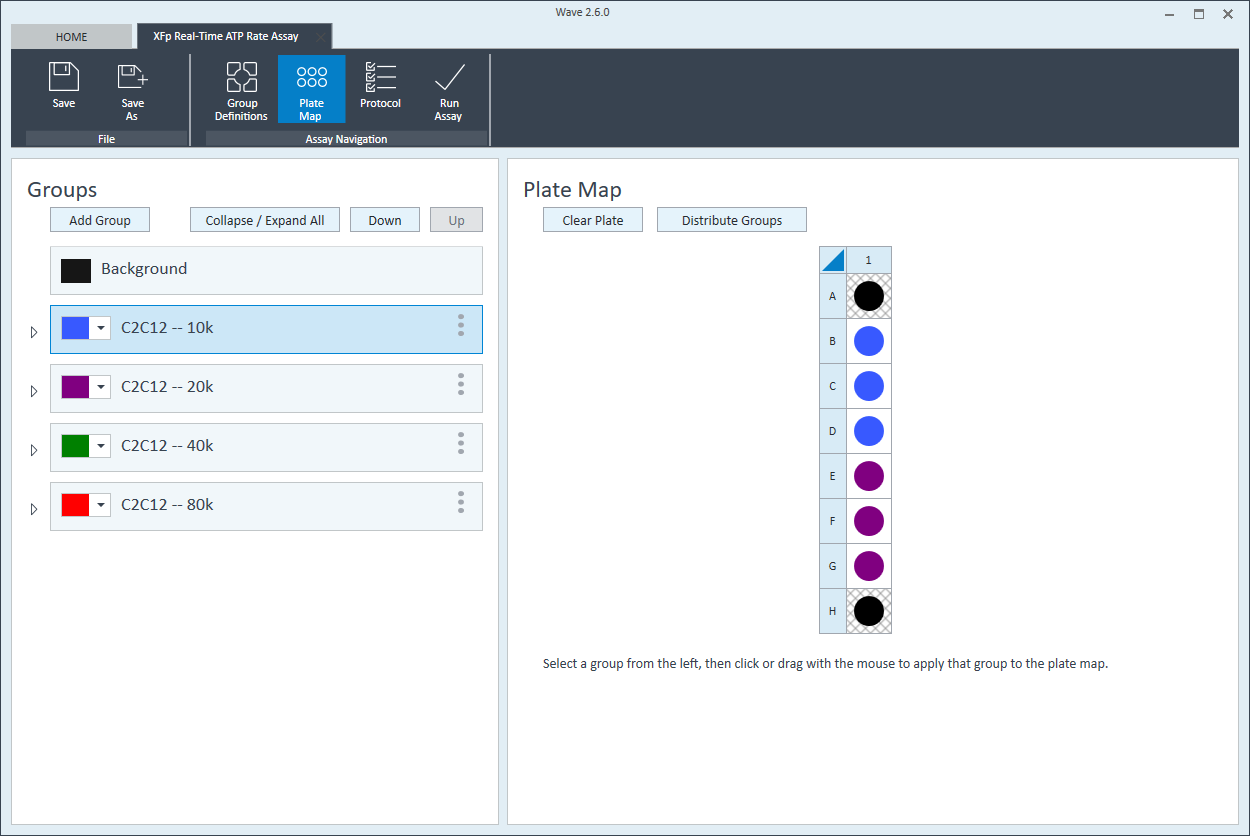
- 完成组命名后,单击 Generate Groups(生成组),将自动创建 4 个独有的分析组。请注意,组名称包含用于简化板布局分配的细胞类型和接种密度。
下一步是将组分配至板布局。
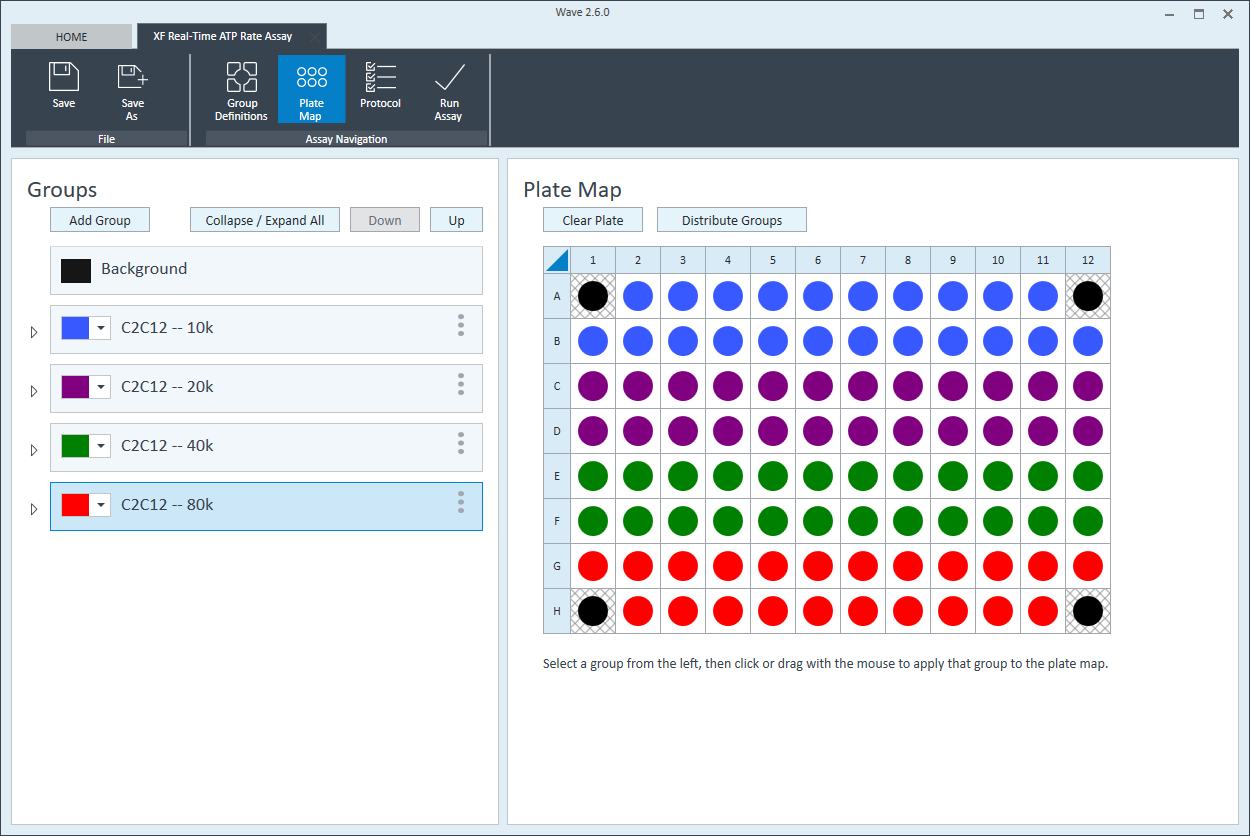
板布局
- 单击功能区(在“分析导航”下方)中的 Plate Map(板布局)。
- 可以自动或手动将组分配到板布局。如需自动分配,请单击 Distribute Groups(分配组)。如需手动分配,请单击组列表中的组名称,然后:
- 单击列标题(即 1、2、3 等)或行标题(即 A、B、C 等)
- 用鼠标左键单击在板布局上拖放一个孔区域。
- 单击板布局上的单个孔。
- 为下一个细胞接种密度组重复上述操作。建议板布局如图所示。
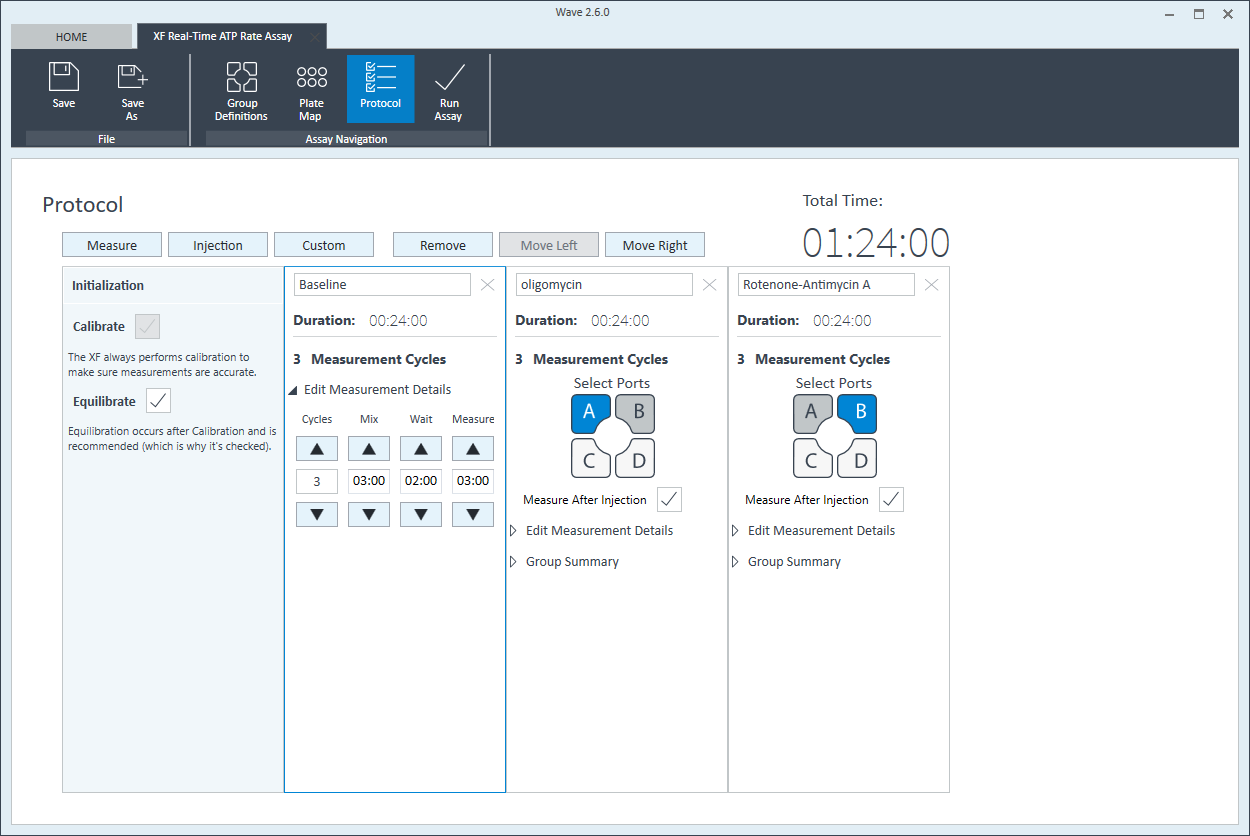
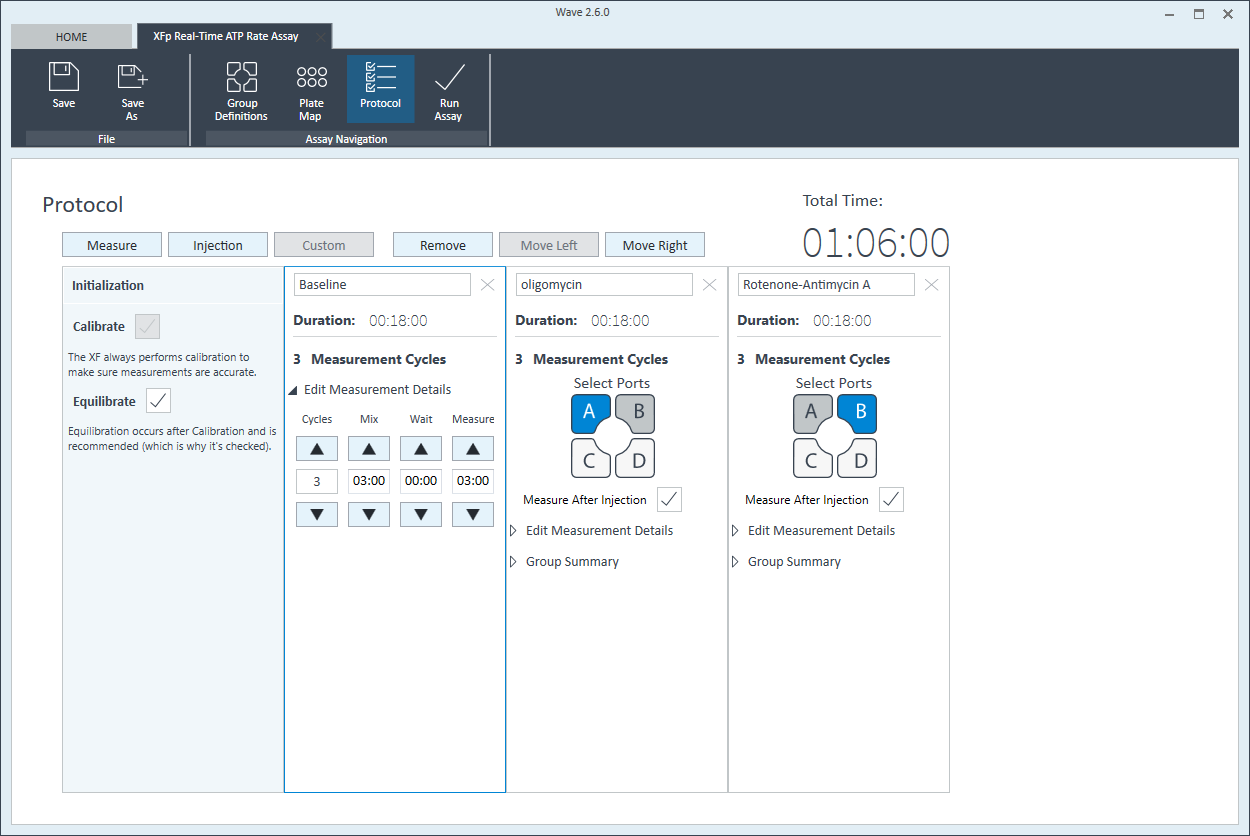
仪器方案
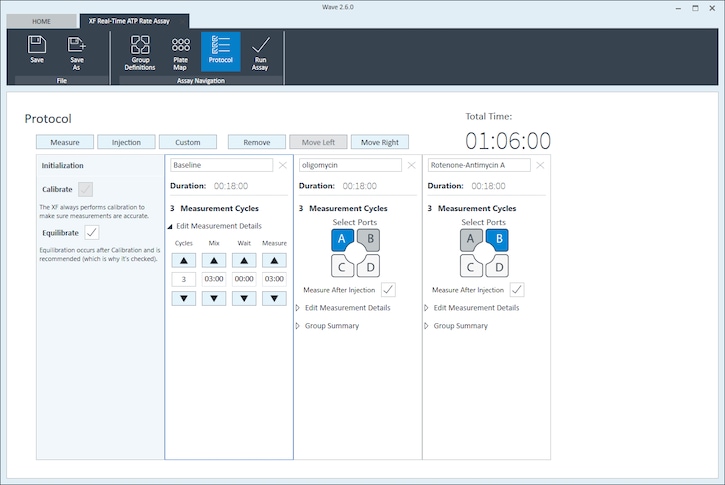
- 单击功能区(在“分析导航”下方)中的 Instrument Protocol(仪器方案),查看或编辑仪器方案。
注意:默认仪器方案不需要修改,但您可以更改方案命令的名称、测定次数或每次测定的时长。修改方案设置将直接影响实验过程中数据的采集方式,因此不建议修改。
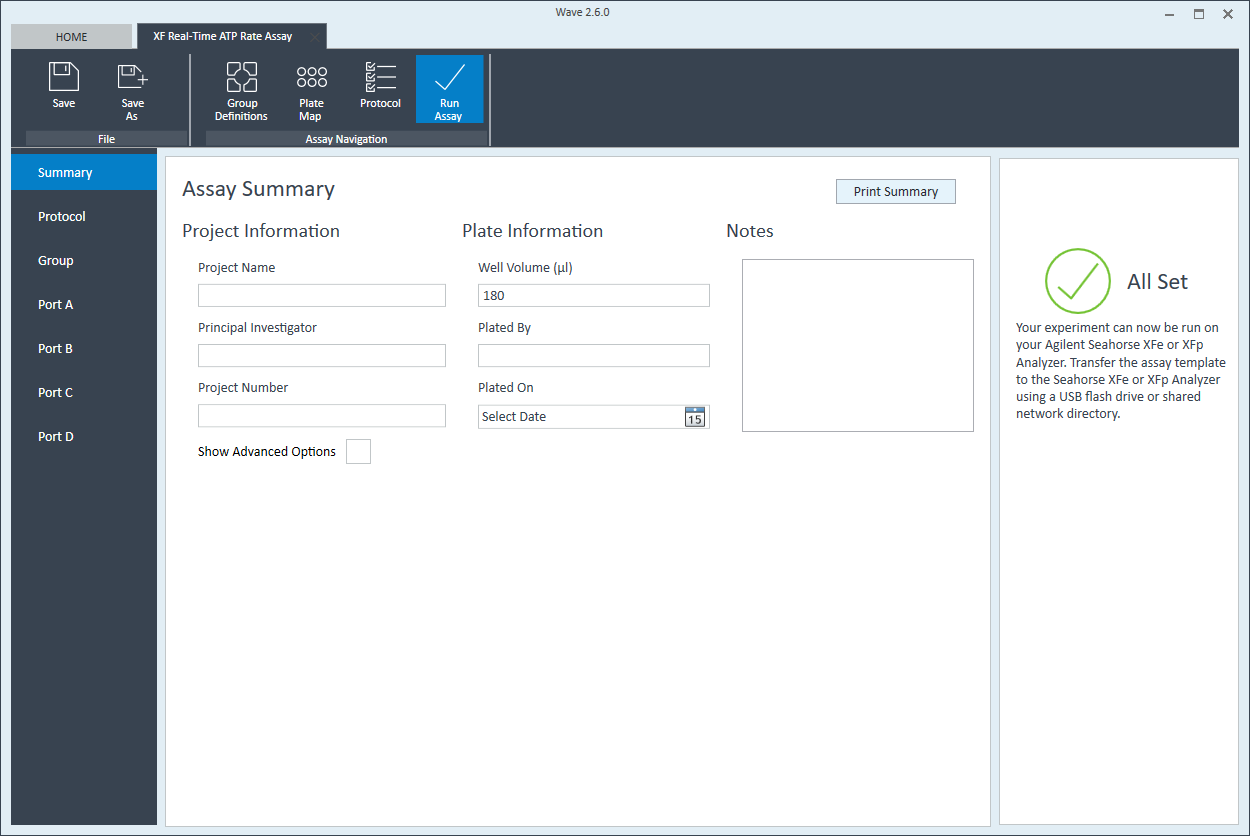
- 最后,单击功能区(在“分析导航”下方)中的运行分析添加其他实验详细信息,保存模板文件,然后启动细胞接种密度优化分析。
- 单击功能区(在“分析导航”下方)中的运行分析,添加其他实验详细信息并保存模板文件。
- 按照 XFp 细胞能量代谢分析仪用户指南中概述的步骤将检测模板文件转移至 XFp 分析仪,以进行第一次细胞接种密度优化分析。
- 按照 XF HS Mini 细胞能量代谢分析仪用户指南中概述的步骤将检测模板文件转移至 XF HS Mini 分析仪,以进行第一次细胞接种密度优化分析。
相关支持材料
2.4 接种细胞
2.3 接种细胞
接种贴壁细胞的基本流程(通常在 XFp HS Mini 分析前一天进行)
对于需要测试的每个密度,根据指导接种贴壁细胞。查看接种悬浮细胞的说明。
安捷伦 Seahorse XFp HS Mini 分析在安捷伦 Seahorse 96 孔 24 孔 8 孔 XFp 细胞培养微孔板 细胞培养迷你板 p、XF HS、XFp PDL 或 XF HS PDL 迷你板上,结合探针板进行。 XFe96 探针板进行。 8 孔探针板进行。本流程介绍了针对安捷伦 Seahorse 分析仪的贴壁细胞接种建议。查看接种悬浮细胞的说明。
首次分析时,建议使用 XF96 细胞培养板、XFe96 探针板和 Seahorse XF 实时 ATP 速率测定试剂盒以及仪器测试四种不同的细胞密度。
首次分析时,建议使用两块细胞培养板、两个探针板和 XF 细胞能量代谢表型测试试剂盒以及仪器测试四种不同的细胞密度和四种不同的 FCCP 浓度。
首次分析时,建议使用 XF24 细胞培养微孔板、XFe24 探针板和 Seahorse XF 实时 ATP 速率测定试剂盒以及仪器测试四种不同的细胞密度。
首次分析时,建议使用 XFp 细胞培养迷你板、XFp 8 孔探针板和 Seahorse XF 实时 ATP 速率测定试剂盒以及 XFp 仪器 XF HS Mini 分析仪测试 2–4 种不同的细胞密度。
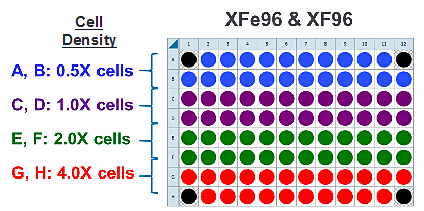
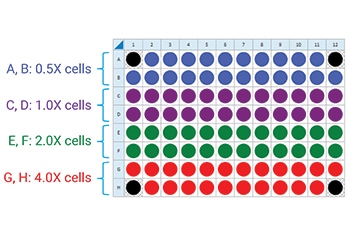
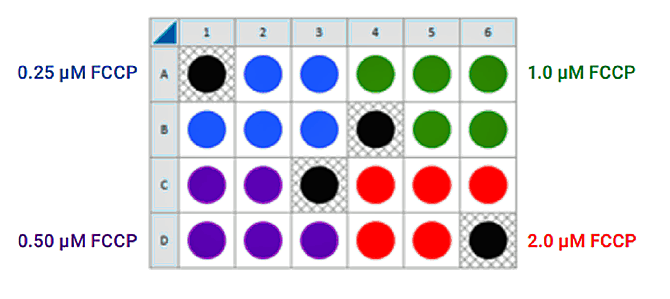
下图是一个用于接种四个细胞密度的建议检测板布局:
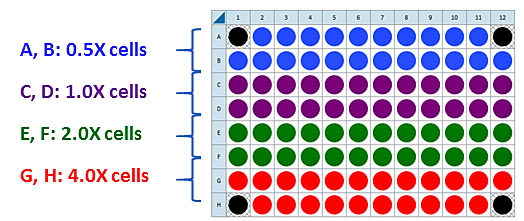
细胞密度滴定分析接种
下图是一个用于接种四个细胞密度的建议检测板布局:
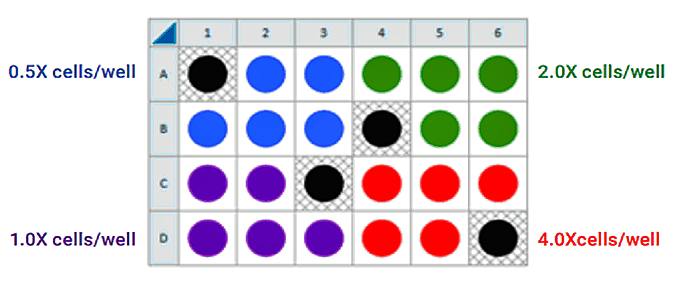

FCCP 浓度滴定分析接种
如果您已经进行了细胞接种密度分析且/或了解了每个孔的最佳细胞数,即可使用除背景校正孔之外的所有孔中接种的最佳细胞数(1.0 × 细胞/孔)进行 FCCP 滴定分析。否则,按照如下说明进行细胞接种和探针板水化/制备,并使用以下推荐的板布局测试四个浓度的 FCCP:
可选择两种工作流程:(1) 对于不限数量的细胞,可在多个 XFp 细胞培养迷你板中以不同浓度接种,以缩短实验间的时间,更快地完成表征工作流程(快速工作流程)。(2) 对于数量有限的细胞,在第一次实验结果确定后,再制备更多细胞(标准工作流程)。根据实测细胞密度和计算的基础速率,下一次细胞数量优化实验可能需要更多或更少的细胞。
| 实验 | 原理 | 快速工作流程 | 标准工作流程 |
|---|---|---|---|
| 以一个或多个不同密度接种细胞,目测细胞融合度;选择迷你板进行下一步骤。 | 为获得仪器动态范围内的代谢率,细胞融合度应为 50%–90%。可以通过目测来初步确定细胞密度是否合适,并在每次分析中进一步验证。 | 根据下图,以 2–4 种不同密度在 1–2 块迷你板上接种。 | 在 1 块迷你板上接种 1 个密度的细胞;水化 1 块 XFp 探针板。 |

2.4.1 XFp 迷你板
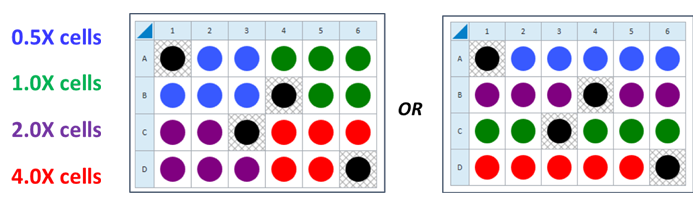
- 根据上述标准或快速工作流程,选择 2–4 个细胞密度进行测试。可选择上述参考文献中的范围,也可接种建议的细胞/孔数值 (1X) 加 0.5X、2X 和 4X 细胞/孔。
- 从蓝色盒子中取出三包迷你板。
- 揭下密封箔,待用。
- 在细胞培养孔周围的水槽中加入无菌水或 PBS。将 8 通道移液器设为 200 µL,填充水槽两侧(每个腔室容纳两个吸头)。如果没有多通道移液器,向水槽的每个腔室加入 400 µL 无菌水或 PBS(共 3200 µL)。
- 向 A 孔和 H 孔中加入 80 µL 生长培养基(无细胞),作为背景校正孔。
- 对于 XFp 迷你板,向 A 孔和 H 孔中加入 80 µL 生长培养基(无细胞),作为背景校正孔。
- 收集并重悬细胞,使其达到在 80 µL 生长培养基中接种的最终所需浓度。最佳细胞接种数量差别很大,通常为 5 × 103 – 4 × 104 细胞/孔,但仍须根据经验确定。(如对于 1 × 104 细胞/孔,每 80 µL 重悬细胞 1 × 104 = 1.25 × 105 细胞/mL)
Seahorse XFp 迷你板具有 8 个孔和一个可减少蒸发的水槽(绿色)
- 对于细胞接种密度优化实验,根据上述标准或快速工作流程,选择 2–4 个细胞密度进行测试。可选择上述参考文献中的范围,也可接种建议的细胞/孔数值 (1X) 加 0.5X、2X 和 4X 细胞/孔。
- 从蓝色盒子中取出三包迷你板。
- 揭下密封箔,待用。
- 在细胞培养孔周围的水槽中加入无菌水或 PBS。将 8 通道移液器设为 200 µL,填充水槽两侧(每个腔室容纳两个吸头)。如果没有多通道移液器,向水槽的每个腔室加入 400 µL 无菌水或 PBS(共 3200 µL)。
- 对于 XFp 迷你板,向 A 孔和 H 孔中加入 80 µL 生长培养基(无细胞),作为背景校正孔。
- 收集细胞并在温热的生长培养基中重悬,使其达到所需浓度。示例请参阅表格,如果 XFp 迷你板需要 1 × 104 细胞/孔,用适当体积重悬细胞,得到 1 × 104 细胞/80 µL/孔 或 1.25 × 105 细胞/mL。
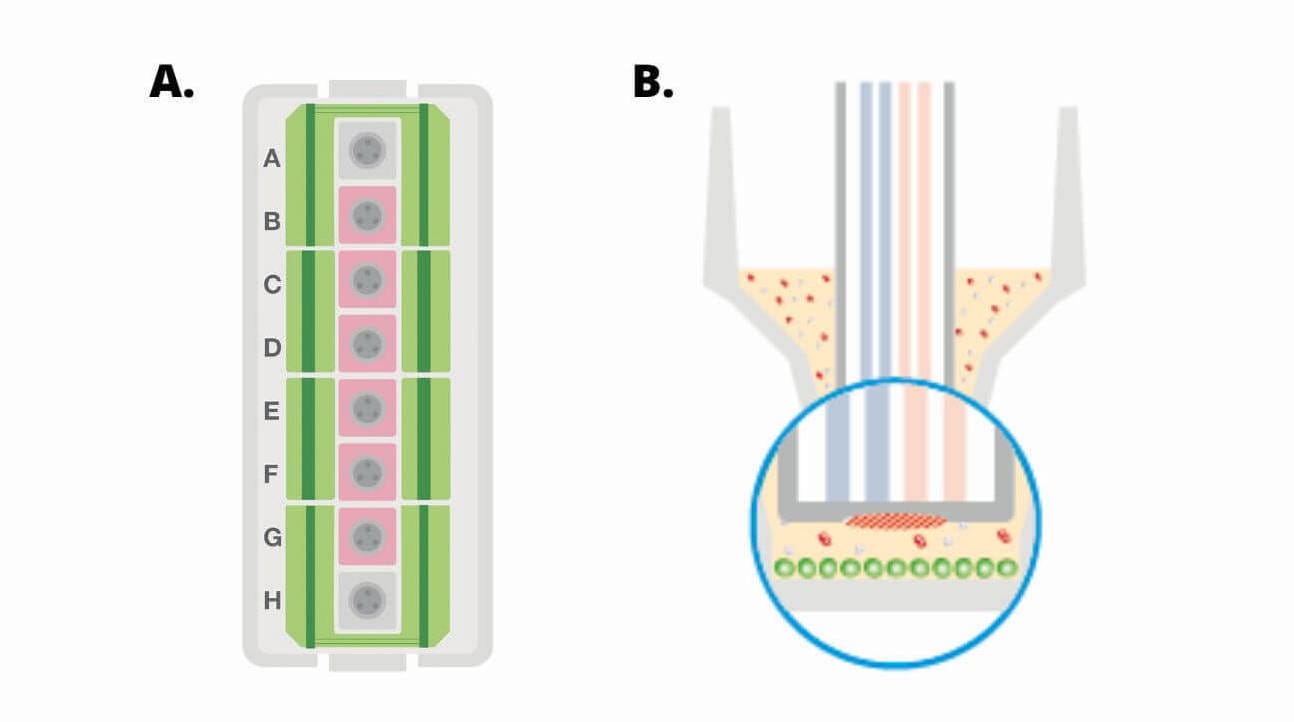
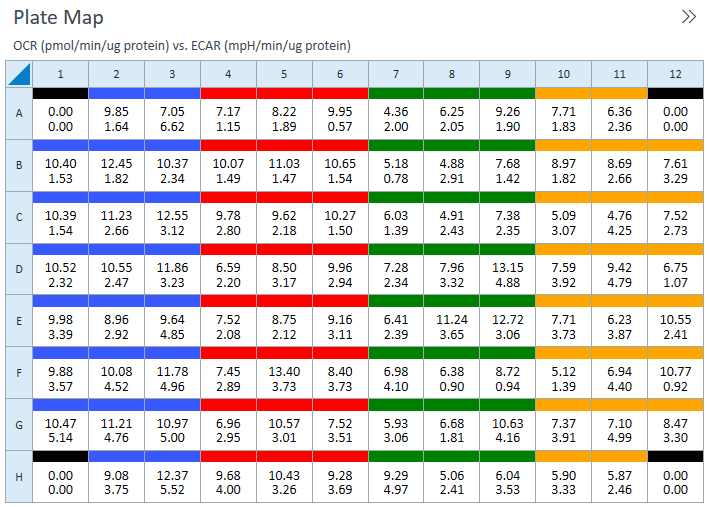
(A) Seahorse XFp 迷你板示意图,显示了带有 8 个腔室的水槽(绿色)、6 个样品孔(B–G,粉色)和背景孔(A、H,灰色)。(B) XFp 迷你板孔的横截面视图,显示了细胞接种区域(绿色圆圈)。
| 孔板类型 | 最终贴壁细胞接种体积 | 最终接种密度(仅示例) | 换算为 mL |
|---|---|---|---|
| XFp 迷你板/ XFp PDL 迷你板 |
80 µL | 1.0 × 104 细胞/80 µL | 1.25 × 105 细胞/mL |
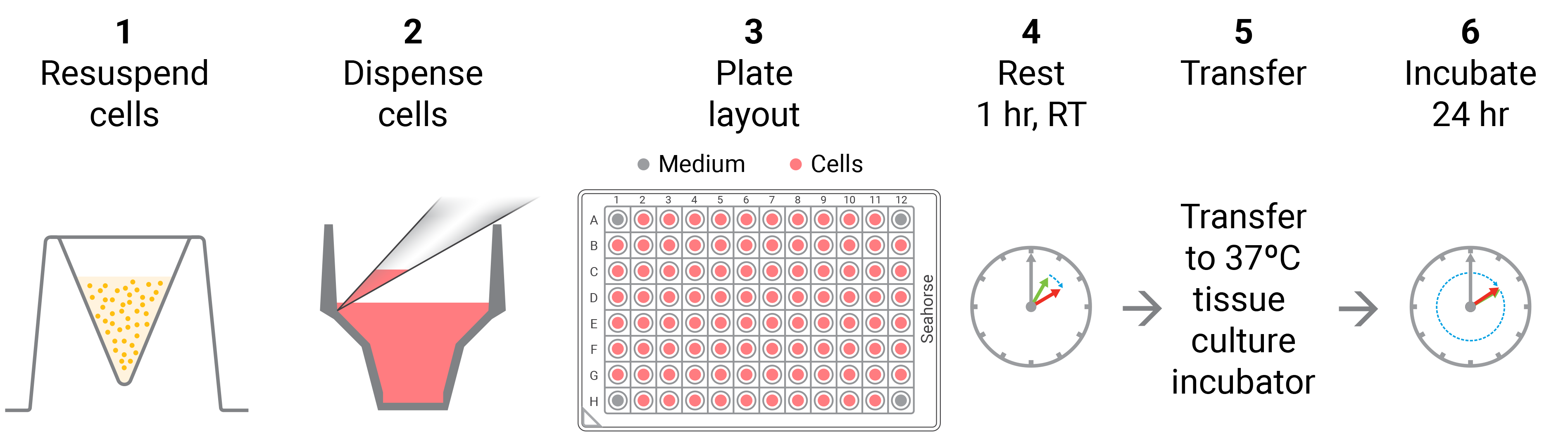
接种贴壁细胞的基本流程(通常在 XF 分析前一天进行)
- 接种安捷伦 Seahorse XF24 细胞培养微孔板时建议采用两步接种过程。该两步过程可获得一致的单层细胞。
- 收集并重悬细胞,使其达到在 80 µL 生长培养基中接种的最终所需浓度。最佳细胞接种数量差别很大,通常为 5 × 103 – 4 × 104 细胞/孔,但仍须根据经验确定。(如对于 1 × 104 细胞/孔,每 80 µL 重悬细胞 1 × 104 = 1.25 × 105 细胞/mL)
- 收集并重悬细胞,使其达到在 100 µL 生长培养基中接种的最终所需浓度。最佳细胞接种数量差别很大,通常为 1 × 104 – 8 × 104 细胞/孔,但仍须根据经验确定。(如对于 2 × 104 细胞/孔,每 100 µL 重悬细胞 2 × 104 = 2.0 × 105 细胞/mL)
- 每孔接种 80 µL 细胞悬液;请勿在背景校正孔(A1、A12、H1、H12)中接种细胞。确保背景校正孔中仅有培养基(无细胞)。
- B–G 每孔接种 80 µL 细胞悬液;请勿在背景校正孔(A 和 H)中接种细胞。确保背景校正孔中仅有培养基(无细胞)。
- 每孔接种 80 µL 细胞悬液。请勿在背景孔 A 和 H 中加入细胞。如果孔底有气泡,可将板以 200 × g 离心 1–2 分钟来去除气泡。
- 每孔接种 100 µL 细胞悬液;请勿在背景校正孔(A1、B4、C3、D6)中接种细胞。确保背景校正孔中仅有培养基(无细胞)。
- 重要提示:在室温下将板在组织培养罩中放置一小时1。这一过程可以促进细胞分布,减少某些细胞类型的边缘效应。用显微镜观察贴壁情况。
- 将板置于标准细胞培养箱中,使细胞贴壁。贴壁能力强的细胞一般需要 1 小时左右即可贴壁,而贴壁能力弱的细胞则需要 5–6 小时。用显微镜观察贴壁情况。
- 一小时后,检查细胞的贴壁情况。
- 如果细胞贴壁情况较好,则分别向每个孔中额外加入 150 μL 细胞生长培养基(共 250 μL),然后将板转移至标准细胞培养箱。
- 如果细胞没有很好地粘附在板上,则还需要 1–5 小时使细胞牢固附着(在生物安全柜中),然后在每个孔中额外加入 150 μL 生长培养基(共 250 μL)并将板转移至标准细胞培养箱。
- 细胞贴壁后,向每个孔加入 150 µL 生长培养基,使每个孔的培养基总体积达到 250 µL。向孔中添加培养基时,由一侧缓慢加入,以免干扰新贴壁细胞。
- 将细胞置于细胞培养箱中培养过夜。用显微镜观察细胞的生长和健康状况。
2.4.2 XF HS 迷你板
- 对于细胞接种密度优化实验,根据上述标准或快速工作流程,选择 2–4 个细胞密度进行测试。可选择上述参考文献中的范围,也可接种建议的细胞/孔数值 (1X) 加 0.5X、2X 和 4X 细胞/孔。
- 从蓝色盒子中取出三包迷你板。
- 揭下密封箔,待用。
- 在细胞培养孔周围的水槽中加入无菌水或 PBS。将 8 通道移液器设为 200 µL,填充水槽两侧(每个腔室容纳两个吸头)。如果没有多通道移液器,向水槽的每个腔室加入 400 µL 无菌水或 PBS(共 3200 µL)。

(A) Seahorse XF HS 迷你板示意图,显示了带有 8 个腔室的水槽(绿色)、6 个样品孔(B–G,粉色)和背景孔(A、H,灰色)。(B) Seahorse XF HS 迷你板每个孔底部有一个“环状”结构,将细胞限制在更小的表面积内,从而形成体积更小的微室,故每孔细胞用量更少。(C) HS 迷你板孔的横截面视图,显示了环状结构和细胞接种区域(绿色圆圈)。
- 向 A 孔和 H 孔中加入 30 µL 生长培养基(不含细胞),作为背景校正孔。
- 收集细胞并在温热的生长培养基中重悬,使其达到所需浓度。示例请参阅表格,如果 XF HS 迷你板需要 3.0 × 103 细胞/孔,用适当体积重悬细胞,得到 3.0 × 103 细胞/30 µL/孔或 1.0 × 105 细胞/mL。
| 孔板类型 | 最终贴壁细胞接种体积 | 最终接种密度(仅示例) | 换算为 mL |
|---|---|---|---|
| XF HS 迷你板/ XF HS PDL 迷你板 |
30 µL | 3.0 × 103 个细胞/30 µL | 1.0 × 105 个细胞/mL |
- 向各孔内的环状元件中接种 30 µL 细胞悬液。建议在 XF HS 迷你板中一次接种一个孔的细胞(移液吸头必须伸入孔底部,用力适中且均匀、平稳地往下按推杆,以确保将细胞悬液顺利排出)。请勿在背景孔 A 和 H 中加入细胞。如果孔底有气泡,可将板以 200 × g 离心 1–2 分钟来去除气泡。
- 重要提示:在室温下将板在组织培养罩中放置一小时1。这一过程可以促进细胞分布,减少某些细胞类型的边缘效应。用显微镜观察贴壁情况。
- 将细胞置于细胞培养箱中培养过夜。用显微镜观察细胞的生长和健康状况。
2.5 准备 XFp PDL 或 XF HS PDL 迷你板(仅适用于悬浮细胞)
使用 XF 技术分析非贴壁细胞(如 T 细胞、白血病细胞系等)需要将细胞固定在孔底,这可以通过在每个孔底包被多聚 D-赖氨酸 (PDL) 来实现。安捷伦提供即用型 PDL 包被的 XFp 和 XF HS 迷你板。它们已经过验证并推荐用于 T 细胞。在接种细胞前,将即用型 PDL 板在 37 °C 无 CO2 培养箱中预热过夜(至少 6 小时)。
XF 分析前一天
准备 XFp PDL 或 HS PDL 迷你板
- 取出 XFp PDL 或 XF HS PDL 迷你板,揭下待使用板的密封箔。
- 将板放入无加湿、无 CO2 培养箱中 37 °C 过夜。
注:XFp PDL 和 XF PDL HS 迷你板与 Agilent XFp 迷你板托盘(部件号 103057-100)兼容。
接种悬浮细胞通常在 XF 分析当天进行,查看第 3.2 节中关于接种悬浮细胞的说明。
相关支持材料
- 在安捷伦 Seahorse XF96 细胞培养微孔板中接种贴壁细胞
- 在安捷伦 Seahorse XF Pro M 细胞培养微孔板中接种贴壁细胞
- 在安捷伦 Seahorse XF24 细胞培养微孔板中接种贴壁细胞
- 在安捷伦 Seahorse XFp 细胞培养迷你板中接种贴壁细胞
- 在安捷伦 Seahorse XF HS 迷你板中接种贴壁细胞
- 在安捷伦 Seahorse XF 细胞培养微孔板中减少细胞生长边缘效应的方法
- 用 Cell-Tak 固定非贴壁细胞后,在安捷伦 Seahorse XFe/XF96 或 XFp 分析仪上进行分析
- 评估安捷伦 Seahorse XF Pro M 细胞培养板的边缘效应和蒸发情况
- 在安捷伦 Seahorse XF HS 迷你板中接种悬浮细胞
- 用 Cell-Tak 固定非贴壁细胞后,在安捷伦 Seahorse XFe/XF24 分析仪上进行分析
- 细胞表征:XFe96/XF96 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XF24 分析仪和细胞能量代谢表型测试
- 细胞表征:XFp 分析仪和 Seahorse XFp 实时 ATP 速率测定
- 细胞表征:XF HS Mini 分析仪和 XF 实时 ATP 速率测定
- 细胞表征:采用 XF HS Mini 分析仪、HS 迷你板进行 XF 实时 ATP 速率测定
参考资料
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 模板
- 安捷伦细胞分析出版物数据库
浏览使用安捷伦细胞分析数据的出版物的完整列表。

仅显示 Seahorse Seahorse XF Pro 的信息
更改仪器类型3. 设置 XF 分析
本部分重点介绍进行 XFp 分析当天所需要的技术,包括检测液制备。接种非贴壁细胞并在 XFp 探针板加药口加载加样溶液。
选择工作流程步骤以显示帮助内容。
3.1 配制检测液
3.1 准备探针板和检测液
准备探针板
- 从培养箱中取出装有校准液的锥形管和带有水化板的组装传感器探针板。
- 将探针板倒置于水化板旁边。
- 倒出并弃去水化板中的水。
- 向水化板的每个孔中加入 200 µL 预热的 XF 校准液。
- 向孔周围的每个水槽填充 400 µL XF 校准液。
- 将传感器探针板置于水化板上,使探针浸入校准液中。
- 在探针板的加药口加样之前,将带水化板的组装传感器探针板放入无 CO2 培养箱中,37 °C 下放置 45–60 分钟。
- 从培养箱中取出带水化辅助板和水化板的组装传感器探针板。
- 将探针板倒置于水化板旁边。
- 取出并丢弃水化辅助板。
- 将传感器探针板置于水化板上,使探针浸入校准液中。
- 将带水化板的组装传感器探针板放回无 CO2 的 37 °C 培养箱中,直到在传感器探针板的加药口加样。
将带水化板的组装传感器探针板放入无 CO2 的 37 °C 培养箱中培养,直到在传感器探针板的加药口加样。
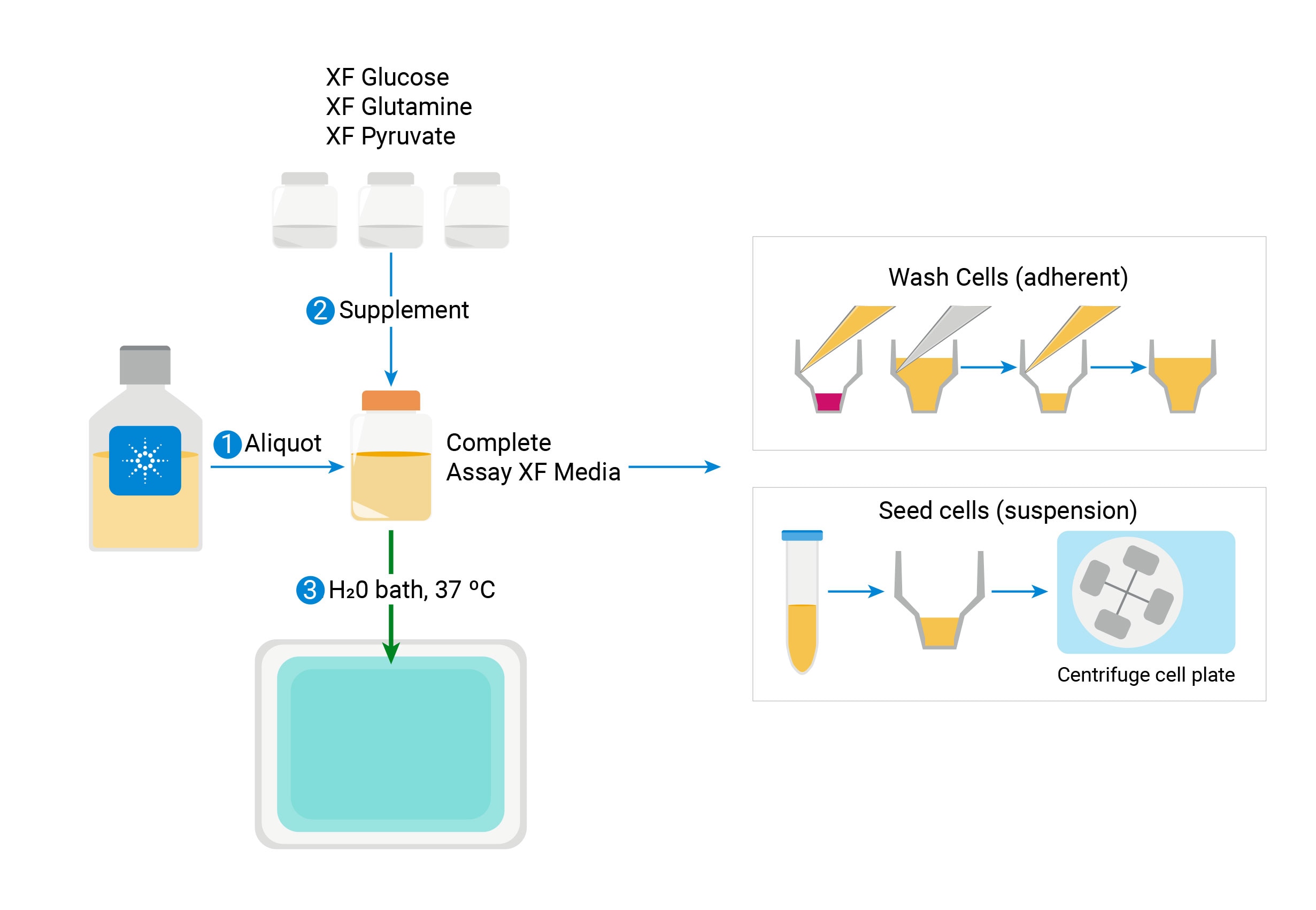
配制 XF 检测液
Seahorse 分析需要特定的检测液以实现准确、稳定的代谢活性功能测量。
安捷伦提供的即用型低缓冲培养基 pH 预调节至 7.4 并含有兼容补充剂,可简化实验准备过程并提供一致性的实验条件。查看关于这款即用型 XF 检测液系统的订购信息或下载检测液选择指南。
或者,研究人员可以使用与所用检测试剂盒匹配的一种成分配制检测液。所有成分均可使用一种安捷伦 Seahorse XF 培养基制备,根据具体实验设计添加不同底物/缓冲液,以下示例是 Seahorse XF 实时 ATP 速率测定细胞能量代谢表型测试。
制备以下 XF 检测液与 Seahorse XF 实时 ATP 速率测定试剂盒一起使用。
配制以下 XF 检测液。
研究人员应使用与所用检测试剂盒匹配的一种成分配制 XF 检测液。所有成分均可使用一种安捷伦 Seahorse XF 培养基制备,根据具体实验设计添加不同底物/缓冲液,以下示例是 Seahorse XF 实时 ATP 速率测定试剂盒细胞能量代谢表型测试。
制备以下 XF 检测液,用于细胞能量代谢表型测试。
| 安捷伦试剂/安捷伦部件号 | 最终浓度 | 体积 | |||
|---|---|---|---|---|---|
| Seahorse XF DMEM 培养基,pH 7.4a, b/103575-100 或 Seahorse XF RPMI 培养基,pH 7.4a, b/103576-100 |
XF 基础培养基(不含酚红)a, b/103335-100 或 XF RPMI(不含酚红)a, b/103336-100 |
Seahorse XF DMEM 培养基a, b/103575-100 或 Seahorse XF RPMI 培养基a, b/103576-100 | - | 97.0 mL | 9.70 mL |
| Seahorse XF 葡萄糖(1.0 M 溶液)/103577-100 | 10 mM | 10 µL | 10 mM | 1.0 mL | 100 µL |
| Seahorse XF 丙酮酸钠(100 mM 溶液)/103578-100 | 1 mM | 1.0 mL | 100 µL | ||
| Seahorse XF L-谷氨酰胺(200 mM 溶液)/103579-100 | 2 mM | 1.0 mL | 100 µL | ||
| a XF DMEM 和 RPMI 培养基 (pH 7.4) 的 pH 值经过预调节,在添加 XF 补充剂后无需调节 pH。请参阅以下制备方法。Seahorse XF DMEM 培养基 (pH 7.4) 和 RPMI 培养基 (pH 7.4) 与 XF24 分析仪不兼容。 b 使用其他类型的 XF 培养基制备 使用其他类型的 XF 培养基制备 使用其他类型的 XF 培养基制备 使用其他类型的 XF 培养基制备 使用其他类型的 XF 培养基制备。 |
|||||
制备 XF DMEM 培养基 pH 7.4 或 XF RPMI 培养基 pH 7.4 的基本流程
制备 XF 基础培养基(不含酚红)或 XF RPMI(不含酚红)的基本流程
所需设备:
- 37 °C 水浴
- 已校准的 pH 计
- 搅拌盘
- 无菌滤瓶(0.22 µm 滤膜)和盖子
- 1.0 N NaOH 溶液
安捷伦 Seahorse XF DMEM 培养基 pH 7.4 和 RPMI 培养基 pH 7.4 旨在实现:
- 便捷性:与推荐的安捷伦 Seahorse XF 补充剂共同使用时,无需调节最终 pH 值。
- 一致性:低浓度 HEPES 缓冲液(5 mM,DMEM;1 mM,RPMI)可获得更为一致的 XF 数据。
- 定量:使用具有固定缓冲容量的检测液,可以定量测定质子释放率 (PER)。
- 将无菌瓶中适当体积的 XF DMEM 培养基 pH 7.4 或 XF RPMI 培养基 pH 7.4 加热至 37 °C。一般而言,一块板需要用 100 mL。
- 将一定量的 XF DMEM 培养基 pH 7.4 或 XF RPMI 培养基 pH 7.4 置于无菌瓶中并加热至 37 °C。一般而言,一块板需要用 100 mL。
- 将无菌瓶中适当体积的 XF 基础培养基(不含酚红)或 XF RPMI(不含酚红)加热至 37 °C。一般而言,一块 XF24 板需要用 100 mL。
- 添加上文表格中提到的适当体积的 Seahorse XF 补充剂(XF 葡萄糖溶液、XF 丙酮酸钠溶液和 XF L-谷氨酰胺溶液)。
- 添加上文表格中提到的适当体积的 Seahorse XF 补充剂(XF 葡萄糖溶液、XF 丙酮酸钠溶液和 XF L-谷氨酰胺溶液)。如果需要使用不同的补充剂浓度,请确认最终 pH 值为 7.4 后再进行操作。
- 添加上文表格中提到的适当体积的 Seahorse XF 补充剂(XF 葡萄糖溶液、XF 丙酮酸钠溶液和 XF L-谷氨酰胺溶液)。如果需要使用不同的补充剂浓度,请确认最终 pH 值为 7.4 后再进行操作。”
- 用 1 N NaOH 将 pH 值调节至 7.4。注:添加 NaOH 后 pH 值将很快发生变化,调节 pH 值时应少量缓慢添加。
- 用 0.2 µm 滤膜对检测液进行灭菌。
- 将最终 XF 检测液于 37 °C 下培养,待用
相关支持材料
- 培训网络研讨会:设置并运行 XF 分析
- 如何水化安捷伦 Seahorse XFe96 探针板
- 如何水化安捷伦 Seahorse XFe24 探针板
- 如何水化安捷伦 Seahorse XF24 探针板
- 如何水化安捷伦 Seahorse XFp 探针板
- 制备 XF 检测液
- 制备 XF 检测液
- 细胞表征:XFe96/XF96 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XFp 分析仪和 Seahorse XFp 实时 ATP 速率测定
- 细胞表征:XF HS Mini 分析仪和 XF 实时 ATP 速率测定
- 细胞表征:采用 XF HS Mini 分析仪、HS 迷你板进行 XF 实时 ATP 速率测定
- 细胞表征:XF24 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XFe24 分析仪和 Seahorse XF 实时 ATP 速率测定
参考资料
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 模板
- 安捷伦细胞分析出版物数据库
浏览使用安捷伦细胞分析数据的出版物的完整列表。
3.2 清洗细胞
清洗接种在 XFp 迷你板上的贴壁细胞的基本流程
注:要清洗 XF HS 迷你板或 XF HS PDL 迷你板内的贴壁细胞,请按下文相关支持材料中的说明操作。
对于 XFp HS Mini 分析之前至少一天接种的贴壁细胞:
- 从 CO2 培养箱中取出细胞培养迷你板。
- 在显微镜下观察细胞:
- 确定细胞健康状况、形态、接种均匀度和纯度(无污染)。
- 确保细胞贴壁,呈均匀单层分布。
- 确保背景校正孔中无细胞。
- 用完整检测液清洗 XF 实时 ATP 速率测定检测液清洗一次贴壁细胞:
- 去除多余检测液,使每孔剩余 20 µL 培养基。剩下少量培养基,以免细胞变干。
- 缓慢加入 200 µL 检测液。
- 在分析之前,将板置于无 CO2 的培养箱中,37 °C 下培养 1 小时。
- 去除多余检测液,使每孔仅剩余 50 µL。剩下少量检测液是为了避免细胞变干。
- 缓慢加入 1 mL 检测液。
- 在分析之前,将板置于无 CO2 的培养箱中,37 °C 下培养 1 小时。
- 重复步骤 b,去除检测液,保留 50 µL(如步骤 a 所述)。
- 添加 450 µL 检测液(总体积 500 µL)用于 24 孔平台仪器。
- 在开始检测之前,用 XF 实时 ATP 速率测定检测液再次清洗细胞:去除检测液,仅剩余 50 µL,然后添加新鲜检测液至终体积 500 µL。在显微镜下观察细胞以确保细胞未被干扰或冲走。
- 在开始检测之前,用 XF 实时 ATP 速率测定检测液再次清洗细胞:去除检测液,仅剩余 20 µL,然后添加新鲜检测液至终体积 180 µL。在显微镜下观察细胞以确保细胞未被干扰或冲走。
- 在显微镜下观察实验孔,确保细胞未被冲走。
- 在分析之前,将板置于无 CO2 的培养箱中,37 °C 下培养 1 小时。
3.2 接种悬浮细胞
在 XF HS PDL 迷你板和 XFp PDL 迷你板上接种悬浮细胞的基本流程
注:有关在 XF HS PDL 迷你板中接种悬浮细胞的更多信息,请按下文相关支持材料中的说明操作。
悬浮细胞的最佳细胞密度取决于细胞大小。通常情况下,最佳细胞密度应使细胞在孔中呈单层分布,融合度为 70%–90%。强烈建议在显微镜下检查细胞分布情况,以确定(1)细胞之间是否有足够的空间以确保所有细胞与包被表面均匀接触,(2)确保细胞簇非常少。如果接种密度超过最佳密度,或如果细胞成簇,会导致细胞粘附较差,从而导致速率测量不准确。


- 对于细胞培养微孔板,将适当体积的细胞悬液从生长管转移到锥形管中。
- 对于 XFp 迷你板、XF HS 迷你板或 XF HS PDL 迷你板,将适当体积的细胞悬液从生长管转移到锥形管中。
- 计算 Seahorse XFe96 所需的细胞总数时,将每个孔所需的细胞数乘以 100 孔。(例如,150000 细胞/孔 × 100 孔 = 1.5 × 107 个细胞)。
- 计算 Seahorse 所需的细胞总数时,将每个孔所需的细胞数乘以 10 孔。(例如,150000 细胞/孔 × 10 孔 = 1.5 × 106 个细胞)。
- 在室温下以 200 × g 离心细胞 5 分钟。
- 离心细胞时,向预热的 PDL 包被的 Seahorse XF96 细胞培养微孔板或 Cell-Tak 包被的 Seahorse XF96 细胞培养板的背景/对照孔中加入 50 µL 检测液。
- 离心细胞时,向预热的 PDL 包被的 Seahorse XFp 细胞培养微孔板或 Cell-Tak 包被的 Seahorse XFp 细胞培养板的背景/校正孔(A 和 H)中加入 50 µL 检测液。
- 从离心的锥形管中弃去上清液。
- 用预热的检测液重悬细胞,以获得 50 µL 检测液所需的每孔细胞浓度。(例如,需要 1.5 × 105 细胞/孔,用适当体积重悬细胞,得到 1.5 × 105 细胞/50 µL 或 3.0 × 106 细胞/mL)。
- 将离心机设置更改为零制动。
- 将细胞悬液转移到无菌组织培养槽中,或直接从锥形管中移取。
- 沿每孔的一侧加入 50 µL 细胞悬液,背景/对照孔除外。建议使用多通道移液器。
- 将迷你微孔板置于 XFp 托盘上,以 300 × g 离心 1 分钟,无制动。该托盘可容纳 3 个迷你微孔板,适用于标准离心机微孔板适配器。确保离心机转子经适当平衡。
- 离心后,目测确认细胞在孔底的贴壁情况。
- 以 200 × g(零制动)离心细胞 1 分钟。确保离心机经适当平衡。
- 注意不要扰乱底部的细胞,轻轻向每孔中加入 130 µL 检测液至所需的初始检测体积 (180 µL)。
- 在细胞培养孔周围的水槽中加入无菌水或 PBS,每腔室 100 µL。将 8 通道移液器(如有)设为 50 µL,每个腔室用两个吸头填充水槽两侧。如果没有多通道移液器,向水槽的每个腔室分别加入 100 µL 无菌水或 PBS(共 800 µL)。
- 将板转移至未补充 CO2 的培养箱中,37 °C 下培养 25–30 分钟,确保细胞完全贴壁。目测确认多数细胞稳定附着在培养板表面。
- 沿每个孔的一侧缓慢加入 130 µL 预热的检测液。注意不要扰乱细胞。
- 在显微镜下观察细胞,确保细胞贴壁。
- 将细胞板放回培养箱中培养 15–25 分钟。
- 15–25 分钟后,细胞板即可用于分析。为获得理想结果,离心后的总时间不超过 1 小时。
- 计算运行 XF 分析所需的细胞总数(每孔所需的细胞数乘以要接种的孔数)。例如,100000 个细胞/孔 × 6 个孔 = 6.0 × 105 个细胞。
- 注意:由于离心以及其他步骤中细胞可能会有损失,建议至少多准备 50% 的细胞。
- 将适当体积的细胞悬液从培养容器转移到锥形管中。
- 在室温下以 200 × g 离心细胞 10 分钟。
- 计算重悬细胞沉淀所需的体积。建议实际所用体积比计算体积小 20%,以避免样品被过度稀释。
- 从离心后的锥形管中弃去上清液。
- 根据计算的体积,用预热好的检测液重悬细胞。
- 再次进行细胞计数,确认细胞密度在所需范围内。必要时,根据所需细胞密度调整体积。
- 将最终的细胞悬液按 50 µL/孔转移到预热好的 XF 96 孔 PDL 细胞培养板中。
- 缓慢离心 PDL 微孔板(例如,以 200 × g 离心 1-2 分钟),使细胞附着在孔底。
- 缓慢加入预热好的 XF 检测液,达到最佳总起始体积,不同实验的总起始体积不同(通常为 175-200 µL)。
- 检测前,将微孔板置于无 CO2 培养箱中,在 37 °C 下孵育 45 分钟。
- 对于 Seahorse XF24 细胞培养微孔板,将适当体积的细胞悬液从生长管转移到锥形管中。
- 计算 Seahorse XF24 所需的细胞总数时,将每个孔所需的细胞数乘以 25 孔。(例如,150000 细胞/孔 × 25 孔 = 3.75 × 106 个细胞)。
- 在室温下以 200 × g 离心细胞 5 分钟。
- 离心细胞时,向室温下 Cell-Tak 包被的 Seahorse XF24 细胞培养板的背景/对照孔中加入 100 µL 检测液。
- 从离心的锥形管中弃去上清液。
- 用预热的检测液重悬细胞,以获得 100 µL 检测液所需的每孔细胞浓度。(例如,需要 1.5 × 105 细胞/孔,用适当体积重悬细胞,得到 1.5 × 105 细胞/100 µL 或 1.5 × 106 细胞/mL)。
- 将离心机设置更改为零制动。
- 将细胞悬液转移到无菌组织培养槽中,或直接从锥形管中移取。
- 沿每孔的一侧加入 100 µL 细胞悬液,背景/对照孔除外。安捷伦建议使用多通道移液器。
- 以 200 × g(零制动)离心细胞 1 分钟。确保离心机经适当平衡。对于 XFp 分析仪用户,安捷伦建议使用安捷伦 Seahorse XFp 托盘离心 Seahorse XFp 细胞培养迷你微孔板。如需了解详细信息,请参阅基本流程:在 XFp 细胞培养微孔板中接种悬浮细胞。
- 将板转移至未补充 CO2 的培养箱中,37 °C 下培养 25–30 分钟,确保细胞完全贴壁。目测确认多数细胞稳定附着在培养板表面。
- 沿每个孔的一侧缓慢加入 400 µL 预热的检测液。注意不要扰乱细胞。
- 在显微镜下观察细胞,确保细胞贴壁。
- 将细胞板放回培养箱中培养 15–25 分钟。
- 15–25 分钟后,细胞板即可用于分析。为获得理想结果,离心后的总时间不超过 1 小时。
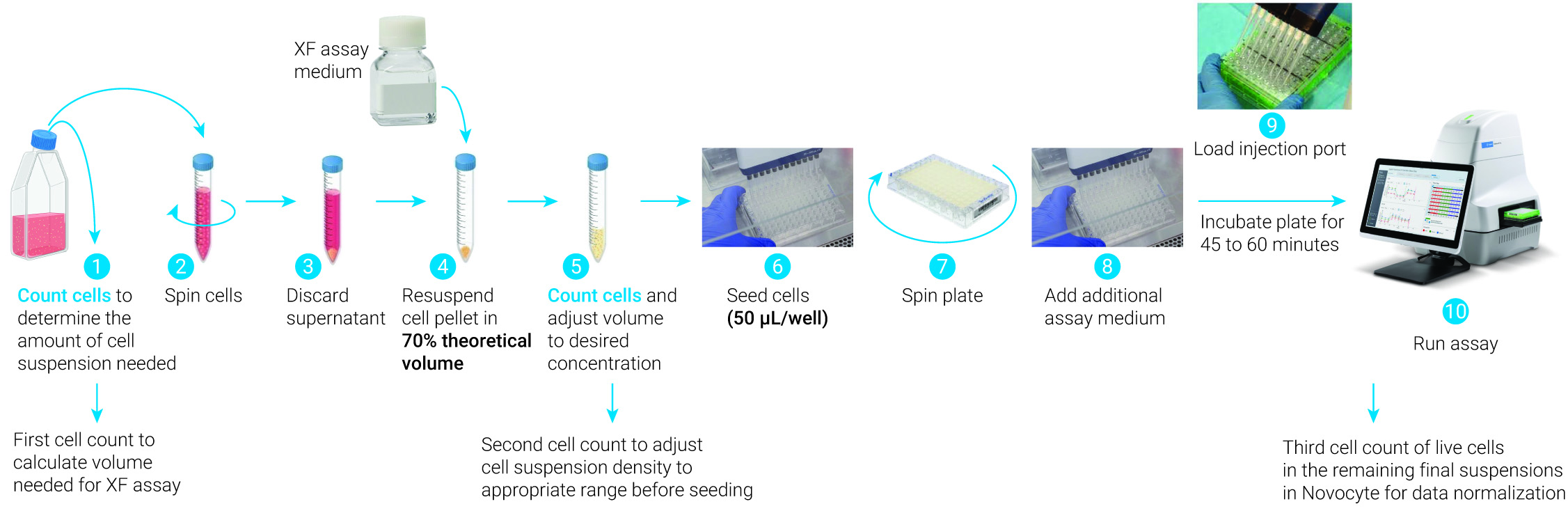
在 XFp PDL 或 XF HS PDL 迷你板上接种悬浮细胞所需的步骤概述。
相关支持材料
- 清洗安捷伦 Seahorse XFp 细胞培养迷你板中的贴壁细胞
- 清洗安捷伦 Seahorse XF96 细胞培养微孔板中的贴壁细胞
- 清洗安捷伦 Seahorse XF24 细胞培养微孔板中的贴壁细胞
- 清洗安捷伦 Seahorse XF96 细胞培养微孔板中的贴壁细胞
- 在安捷伦 Seahorse XF 实验中使用 Agilent NovoCyte 流式细胞仪进行免疫细胞悬液归一化
- 清洗安捷伦 Seahorse XF24 细胞培养微孔板中的贴壁细胞
- 用 Cell-Tak 固定非贴壁细胞后,在安捷伦 Seahorse XFe96/XF96 或 XFp 分析仪上进行分析
- 用 Cell-Tak 固定非贴壁细胞后,在安捷伦 Seahorse XFe24/XF24 分析仪上进行分析
- 在安捷伦 Seahorse XF HS 迷你板中接种悬浮细胞
- 在安捷伦 Seahorse XFp 细胞培养迷你微孔板中接种悬浮细胞
- 细胞表征:XFe96/XF96 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XF24 分析仪和细胞能量代谢表型测试
- 细胞表征:XFe24 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XFp 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XF HS Mini 分析仪和 XF 实时 ATP 速率测定
- 细胞表征:采用 XF HS Mini 分析仪、HS 迷你板进行 XF 实时 ATP 速率测定
参考资料
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 模板
- 安捷伦细胞分析出版物数据库
浏览使用安捷伦细胞分析数据的出版物的完整列表。
3.2.1 XFp PDL 迷你板
- 从无 CO2 37 °C 培养箱(未控制湿度)中取出 XFp PDL 迷你板。
- 在细胞培养孔周围的水槽中加入无菌水或 PBS,每腔室 400 µL。将 8 通道移液器(如有)设为 200 µL,每个腔室用两个吸头填充水槽两侧。如果没有多通道移液器,向水槽的每个腔室分别加入 400 µL 无菌水或 PBS(共 3200 µL)。
- 确定所需接种浓度。悬浮细胞的最佳细胞密度取决于细胞大小。对于 XFp PDL 迷你板,接种数量通常为 5 × 104 到 2 × 105 细胞/孔。
- 将每个孔所需的细胞数乘以 10 孔,计算每块迷你板所需的细胞总数(例如,150000 细胞/孔 × 10 个孔 = 1.5 × 106 个细胞)。然后将适当体积的细胞悬液从生长管转移到锥形管中。
- 在室温下以 200 × g 离心细胞 5 分钟。然后从离心的锥形管中弃去上清液,并用预热的检测液重悬细胞至所需浓度。例如,如需要 1.5 × 105 细胞/孔,用适当体积重悬细胞,以得到 1.5 × 105 细胞/50 µL/孔或 1.0 × 106 细胞/mL。
- 向背景孔(A 和 H)中添加 50 µL 检测液。
- 将离心机设置更改为零制动。
- 将细胞悬液转移到无菌组织培养槽中,或直接从锥形管中移取。
- 沿每孔的一侧加入 50 µL 细胞悬液,背景/对照孔(A 和 H)除外。建议使用多通道移液器。
- 向板中加入细胞或检测液后,孔底部可能形成气泡。这些气泡也许能够通过离心去除。
- 将迷你板置于 XFp 托盘上,以 200 × g 离心 1 分钟,使细胞附着在孔底。该托盘可容纳 3 个迷你板,适用于标准离心机微孔板适配器。确保离心机转子经适当平衡。
- 离心后,目测确认细胞在孔底的贴壁情况。
- 轻轻向每孔中加入 130 µL 检测液至所需的初始检测体积 (180 µL)。
- 使用前,将细胞板置于无 CO2 培养箱中,37 °C 下培养 45–60 分钟。目测确认多数细胞稳定附着在培养板表面。
- 为获得理想结果,离心后的总时间不超过 1 小时。
- 前往第 3.4 节
3.2.2 XF HS PDL 迷你板
- 从无 CO2 37 °C 培养箱(未控制湿度)中取出 XF HS PDL 迷你板。
- 在细胞培养孔周围的水槽中加入无菌水或 PBS,每腔室 400 µL。将 8 通道移液器(如有)设为 200 µL,每个腔室用两个吸头填充水槽两侧。如果没有多通道移液器,向水槽的每个腔室分别加入 400 µL 无菌水或 PBS(共 3200 µL)。
- 确定所需接种浓度。悬浮细胞的最佳细胞密度取决于细胞大小。对于 XF HS PDL 迷你板,接种数量通常为 2.0 × 104 到 7.0 × 104 细胞/孔。
- 将每个孔所需的细胞数乘以 10 孔,计算每块迷你板所需的细胞总数(例如,150000 细胞/孔 × 10 个孔 = 1.5 × 106 个细胞)。然后将适当体积的细胞悬液从生长管转移到锥形管中。
- 在室温下以 200 × g 离心细胞 5 分钟。然后从离心的锥形管中弃去上清液,并用预热的检测液重悬细胞至所需浓度。例如,如需要 3 × 104 细胞/孔,用适当体积重悬细胞,以得到 3 × 104 细胞/30 µL/孔 或 1.0 × 106 细胞/mL。
- 向背景孔(A 和 H)中添加 30 µL 检测液。
- 将离心机设置更改为零制动。
- 将细胞悬液转移到无菌组织培养槽中,或直接从锥形管中移取。
- 向各孔内的环状元件中添加 30 µL 细胞悬液。建议使用 200 µL(或更小)的移液吸头,一次接种一个孔的细胞。移液吸头必须伸入孔底部以确保正确排液。请勿在背景孔 A 和 H 中加入细胞。
- 向板中加入细胞或检测液后,孔底部可能形成气泡。这些气泡也许能够通过离心去除。
- 将迷你板置于 XFp 托盘上,以 200 × g 离心 1 分钟,使细胞附着在孔底。该托盘可容纳 3 个迷你板,适用于标准离心机微孔板适配器。确保离心机转子经适当平衡。
- 离心后,目测确认细胞在孔底的贴壁情况。
- 使用遮罩拆卸工具小心取下硅胶遮罩:
- 一只手拿板,平放在实验台或工作台上。另一只手将工具插入板顶部和遮罩之间。
- 插入拆卸工具时,其尖头应与板的顶部保持平行。
- 请勿来回撬动以使工具插入更深,这一操作将产生吸力,并可能会干扰细胞层。
- 目标是一次性同时取下所有孔的遮罩。
- 工具完全插入时,撬动取下遮罩。
- 遮罩不会固定在尖头上,遮罩与板开始分离后,请用手指将遮罩固定在工具上,防止其掉落到板上。
- 板遮罩取下后请丢弃。
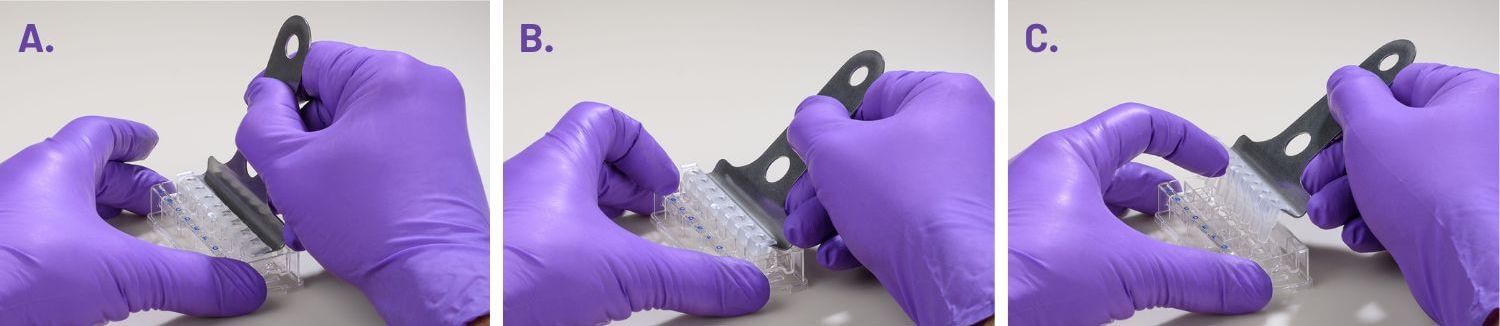
(A) 将拆卸工具的尖头插入每个孔之间,使工具底部与板顶部保持平行。
(B) 尖头插入后,从板孔上撬动遮罩。
(C) 从板里提起遮罩时,用一根手指将遮罩按在拆卸工具上,防止其掉落。
注:在取下硅胶遮罩的同时也会带出检测液。每个孔中将剩余 20 µL 左右的检测液。如果剩余量不一致,则仅需从孔的外环区域小心吸出,注意不要接触环内的细胞。请务必留下一些检测液来覆盖细胞。每个孔总体积的微小差异不会影响 OCR 或 ECAR,但加样试剂的最终浓度可能会受到影响。
- 轻轻向每孔中加入 160 µL 检测液至所需的初始检测体积 (180 µL)。
- 使用前,将细胞板置于无 CO2 培养箱中,37 °C 下培养 45–60 分钟。目测确认多数细胞稳定附着在培养板表面。
- 为获得理想结果,离心后的总时间不超过 1 小时。
- 前往第 3.4 节
3.3 清洗贴壁细胞的基本流程
3.3.1 清洗 XFp 迷你板中的贴壁细胞
对于 XF HS Mini 分析之前至少一天接种的贴壁细胞:
- 从 CO2 培养箱中取出细胞培养迷你板。
- 在显微镜下观察细胞:
- 确定细胞健康状况、形态、接种均匀度和纯度(无污染)。
- 确保细胞贴壁,呈均匀单层分布。
- 确保背景校正孔中无细胞。
- 用 XF 检测液清洗细胞:
- 去除多余检测液,使每孔剩余 20 µL 培养基。剩下少量培养基,以免细胞变干。
- 缓慢加入 200 µL 检测液。
- 在分析之前,将板置于无 CO2 的培养箱中,37 °C 下培养 1 小时。
- 在开始检测之前,用 XF 实时 ATP 速率测定检测液再次清洗细胞:去除检测液,仅剩余 20 µL,然后添加新鲜检测液至终体积 180 µL。在显微镜下观察细胞以确保细胞未被干扰或冲走。
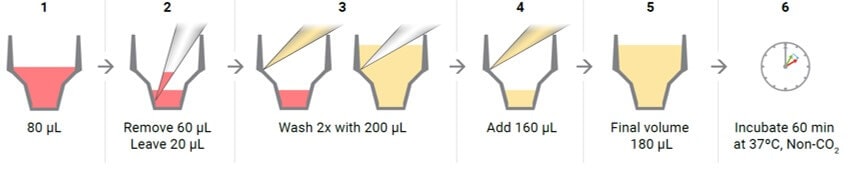
3.3.2 清洗 XF HS 迷你板中的贴壁细胞
对于 XF HS Mini 分析之前至少一天接种的贴壁细胞:
- 从 CO2 培养箱中取出细胞培养迷你板。
- 在显微镜下观察细胞:
- 确定细胞健康状况、形态、接种均匀度和纯度(无污染)。
- 确保细胞贴壁,呈均匀单层分布
- 确保背景校正孔中无细胞
- 在 XF 分析之前,使用遮罩拆卸工具取下硅胶遮罩:
- 一只手拿板,平放在实验台或工作台上。然后,另一只手将工具插入板顶部和遮罩之间。
- 插入拆卸工具时,其尖头应与板的顶部保持平行。
- 请勿来回撬动以使工具插入更深,这一操作将产生吸力,并可能会干扰细胞层。
- 目标是一次性同时取下所有孔的遮罩。
- 工具完全插入时,撬动取下遮罩。
- 遮罩不会固定在尖头上,遮罩与板开始分离后,请用手指将遮罩固定在工具上,防止其掉落到板上。
- 板遮罩取下后请丢弃。

(A) 将拆卸工具的尖头插入每个孔之间,使工具底部与板顶部保持平行。
(B) 尖头插入后,从板孔上撬动遮罩。
(C) 从板里提起遮罩时,用一根手指将遮罩按在拆卸工具上,防止其掉落。
注:在取下硅胶遮罩的同时也会带出检测液。每个孔中将剩余 20 µL 左右的检测液。如果剩余量不一致,则仅需从孔的外环区域小心吸出,注意不要接触环内的细胞。请务必留下一些检测液来覆盖细胞。每个孔总体积的微小差异不会影响 OCR 或 ECAR,但加样试剂的最终浓度可能会受到影响。
- 用 XF 检测液清洗细胞:
- 缓慢加入 200 µL 检测液,然后从每个孔中去除检测液,仅剩余 20 µL,然后重复清洗过程。
- 最后,加入检测液(约 160 µL),以达到 180 µL/孔的起始体积。
- 清洗完成后观察细胞层以确保细胞未被干扰或冲走。在进行分析之前,将清洗过的细胞板置于无 CO2 培养箱中,在 37 °C 下孵育 60 分钟。
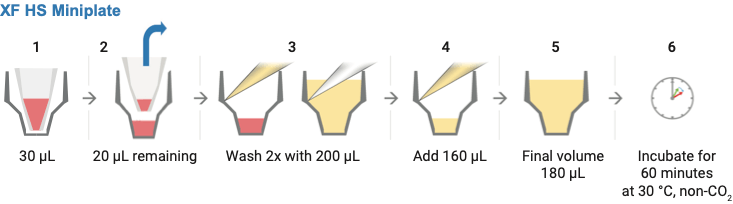
示意图展示了取下硅胶遮罩(步骤 2)以及用 XF 检测液清洗 XF HS 迷你板中的样品所需的步骤
3.3 配制溶液
3.4 配制溶液
安捷伦 Seahorse 分析仪的一个关键特性是它能够在分析过程中对试剂加样并实时查看结果。排出放入仪器前已上样至探针板加药口的溶液,可实现这一过程。
如果使用细胞能量代谢表型分析进行细胞密度和/或 FCCP 滴定的初始细胞表征,则按下表所述制备加样溶液。
如果使用 Seahorse XFp 实时 ATP 速率测定进行细胞密度的初始细胞表征,则按下表所述制备加样溶液。
如果使用 Seahorse XF 实时 ATP 速率测定进行细胞密度的初始细胞表征,则按下表所述制备加样溶液。
细胞密度滴定检测溶液配制
FCCP 浓度滴定检测溶液配制
- 从 Seahorse XF 实时 ATP 速率测定试剂盒中取出一个试剂包,取出两个样品管(寡霉素和鱼藤酮 + 抗霉素 A)。
- 从 Seahorse XF 细胞能量代谢表型测试试剂盒中取出一个试剂包,取出两个样品管(寡霉素和 FCCP)。
- 使用移液器,利用配制的检测液重悬每管的内容物,体积如下表所述。盖上管盖,涡旋混合 1 分钟使化合物溶解。
| Seahorse XF 实时 ATP 速率测定试剂盒的重悬体积 | ||||
|---|---|---|---|---|
| 化合物 | XF 检测液体积 | 最终储备液浓度 | ||
| 寡霉素 | 420 µL | 168 µL | 150 µM | 75 µM |
| 鱼藤酮 + 抗霉素 A | 540 µL | 216 µL | 50 µM | 25 µM |
| XF 细胞能量代谢表型测试试剂盒的重悬体积 | ||
|---|---|---|
| XF 细胞能量代谢表型测试试剂盒组成 | XF 检测液体积 (µL) | 最终储备液浓度 (µM) |
| 寡霉素 | 630 | 100 |
| FCCP | 720 | 100 |
- 如下表所述,通过合并适当体积的 XF 检测液、寡霉素储备液和鱼藤酮/抗霉素 A 储备液制备 3.0 mL 每种加样溶液。
- 如下表所述,使用 15 mL 锥形管,通过合并适当体积的 XF 检测液、寡霉素储备液和 FCCP 储备液制备 3.0 mL 加样溶液。
- 如下表所述,通过合并适当体积的 XF 检测液、寡霉素储备液和鱼藤酮/抗霉素 A 储备液制备 300 µL 每种加样溶液。
| XF 实时 ATP 速率测定试剂盒的稀释体积 — 细胞表征 | ||||||
|---|---|---|---|---|---|---|
| 加药口和化合物 | 储备液体积 | XF 检测液体积 | 10X [加药口] | [细胞孔] | ||
| 加药口 A 寡霉素 | 300 µL | 60 µL | 2700 µL | 240 µL | 15 µM | 1.5 µM |
| 加药口 B 鱼藤酮 + 抗霉素 A | 300 µL | 60 µL | 2700 µL | 240 µL | 5 µM | 0.5 µM |
| XF 细胞能量代谢表型测试试剂盒的稀释体积 — XFe24/XF24 细胞接种密度滴定 | |||||
|---|---|---|---|---|---|
| 孔内的最终 FCCP 浓度 | 检测液体积 (µL) | 寡霉素储备液体积 (μL) | FCCP 储备液体积 (µL) | 10X 最终寡霉素(加药口)浓度 (μM) | 10X 最终 FCCP(加药口)浓度 (μM) |
| 0.25 | 875 | 100 | 25 | 10 | 2.5 |
| 0.5 | 850 | 100 | 50 | 10 | 5.0 |
| 1.0 | 800 | 100 | 100 | 10 | 10 |
| 2.0 | 700 | 100 | 200 | 10 | 20 |
如果进行不同类型的 XFp HS Mini 分析,查阅相应 XFp HS Mini 试剂盒用户指南了解相应的加样溶液制备说明。
相关支持材料
- 安捷伦 Seahorse 传感器探针板加药口加样
- 安捷伦 Seahorse XFe24 传感器探针板加药口加样
- 安捷伦 Seahorse XF24 传感器探针板加药口加样
- 安捷伦 Seahorse XFp 传感器探针板加药口加样
- 细胞表征:XFe96/XF96 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XF24 分析仪和细胞能量代谢表型测试
- 细胞表征:XFe24 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XFp 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XF HS Mini 分析仪和 XF 实时 ATP 速率测定
- 细胞表征:采用 XF HS Mini 分析仪、HS 迷你板进行 XF 实时 ATP 速率测定
参考资料
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 模板
- 安捷伦细胞分析出版物数据库
浏览使用安捷伦细胞分析数据的出版物的完整列表。
3.4 加载加样溶液
3.5 加载加样溶液
3.4 准备探针板和加载加样溶液
如果使用 Seahorse XF 实时 ATP 速率测定进行初始细胞表征(细胞密度检测),请按照以下说明和表格进行探针板加药口加样。
如果使用细胞能量代谢表型分析进行初始细胞表征(细胞密度和 FCCP 浓度滴定分析),请按照以下说明和表格进行探针板加药口加样。
注意:对于这些实验设计,仅使用 A 和 B 加药口。
传感器探针板加药口布局
- 从无 CO2 培养箱中取出水化探针板。
- 从培养箱中取出与 XF 水化辅助板和水化板组装的探针板。
- 将探针板倒置于水化板旁边。
- 用一只手稳稳扶住水化板,用另一只手从一个角抬起 XF 水化辅助板,将其取下。
- 将探针板放回到水化板上。不要盖上探针板盖。
- 定位安捷伦 Seahorse XF 分析探针板。将行标签(标有字母 A–H)放在左边。三角形缺口在左下角。
- 定位安捷伦 Seahorse XF 分析探针板。将行标签(标有字母 A–D)放在左边。三角形缺口在左下角。
- 定位安捷伦 Seahorse XFp 分析探针板。将孔标签(标有字母 A–H)放在左边。三角形缺口在左下角。
- 使用量程为 100 或 200 µL 的(多通道)移液器,确保吸头牢固安装在移液器上,将移液吸头(填充加样化合物)放入目标加药口中,使吸头略微倾斜一定角度 (< 5°)。请勿用强力将吸头完全插入孔中。
- 将 A/D 上样导轨平面置于分析探针板顶部。定位上样导轨,使字母 A 位于左上角。上样时用指尖捏住上样导轨的外缘使之保持稳定,从而使移液吸头不会移动上样导轨。
- 使用量程为 10-100 µL 的多通道移液器,确保吸头牢固安装在移液器上。将移液吸头(填充加样化合物)放入上样导轨的目标列中,使吸头略微倾斜一定角度。在无阻力的前提下,将吸头尽可能插入孔中并排出化合物。请勿用强力将吸头完全插入孔中。
- 根据如下所示的板/组布局,缓慢地向加药口排出 20 µL 的适当加样溶液。在整个操作过程中,小心从加药口移走吸头,使上样导轨保持稳定。避免产生气泡。请勿敲击探针板的任何部位试图缩小气泡。敲击可能使溶液从加药口泄漏。
- 取下 A/D 加药口上样导轨,并换上 B/C 加药口上样导轨,使“B”在左上角。使用 22 µL 加样溶液重复上述步骤为加药口 B 上样。
- 目测加药口加样是否均匀。液体应在加药口中,确保探针板顶端无残余液滴。


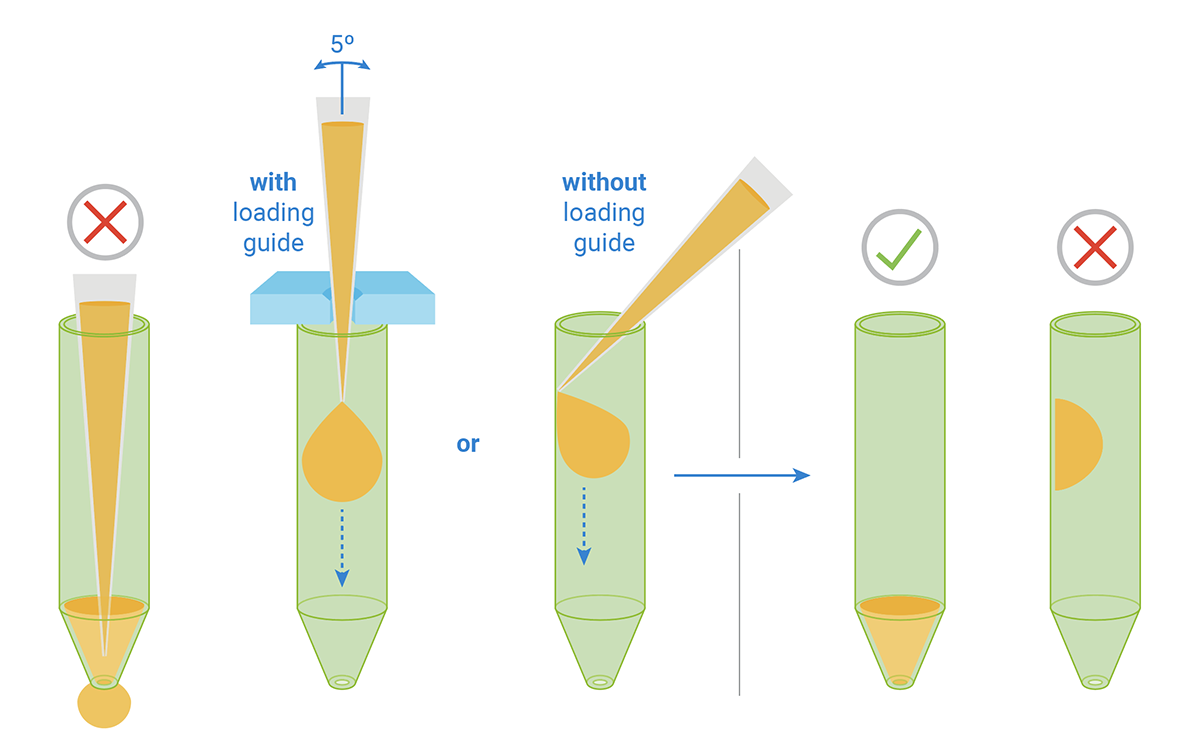


- 将 A/D 上样导轨平面置于分析探针板顶部。定位上样导轨,使字母 A 位于左上角。上样时用指尖捏住上样导轨的外缘使之保持稳定,从而使移液吸头不会移动上样导轨。
- 使用量程为 10-100 µL 的多通道移液器,确保吸头牢固安装在移液器上。将移液吸头(填充加样化合物)放入上样导轨的目标列中,使吸头略微倾斜一定角度。在无阻力的前提下,将吸头尽可能插入孔中并排出化合物。请勿用强力将吸头完全插入孔中。
- 使吸头保持 45° 角。将吸头一半放入加药口,吸头的斜角抵在加药口的另一面。
- 请勿将吸头完全插入加药口底部,否则可能会导致化合物通过加药口泄漏。
- 根据如下所示的板/组布局,缓慢地向加药口排出 20 µL 的适当加样溶液。在整个操作过程中,小心从加药口移走吸头,使上样导轨保持稳定。避免产生气泡。请勿敲击探针板的任何部位试图缩小气泡。敲击可能使溶液从加药口泄漏。
- 按所进行的分析,根据如下所示的板/组布局,缓慢地向加药口排出 55 µL 适当加样溶液。小心从加药口移走吸头。避免产生气泡,请勿敲击探针板的任何部位试图缩小气泡。敲击可能使溶液从加药口泄漏。
- 根据如下所示的板/组布局,缓慢地向加药口排出 20 µL 适当上样溶液。在整个操作过程中,小心从加药口移走吸头,使探针板保持稳定。避免产生气泡。请勿敲击探针板的任何部位试图缩小气泡。敲击可能使溶液从加药口泄漏。
- 取下 A/D 加药口上样导轨,并换上 B/C 加药口上样导轨,使“B”在左上角。使用 22 µL 加样溶液重复上述步骤为加药口 B 上样。
- 使用 62 µL 加样溶液重复上述步骤为加药口 B 上样。
- 使用 22 µL 加样溶液重复上述步骤为加药口 B 上样。
- 目测加药口加样是否均匀。液体应在加药口中,确保探针板顶端无残余液滴。
用于细胞密度滴定分析的加药口加样
| XF 实时 ATP 速率测定试剂盒的加药口和体积 — 细胞表征 | ||||
|---|---|---|---|---|
| 加药口和化合物 | 体积 | 10X [加药口] | [细胞孔] | |
| 加药口 A 寡霉素 | 20 µL | 55 µL | 15 µM | 1.5 µM |
| 加药口 B 鱼藤酮 + 抗霉素 A | 22 µL | 62 µL | 5 µM | 0.5 µM |
| 孔内最终浓度 (µM) | FCCP 组 | 孔 | 加药口/体积 (µL) |
|---|---|---|---|
| 寡霉素/FCCP 1.0/1.0 | 1.0 µM | A1–D6(所有) | A/55 |
用于 FCCP 浓度滴定分析的加药口加样
如果进行不同类型的 XF 分析,请参阅相应的 XF 试剂盒用户指南和下方说明,了解多个加样溶液的上样方法。
- 定位安捷伦 Seahorse XF 分析探针板。将行标签(标有字母 A–H)放在左边。三角形缺口在左下角。
- 定位安捷伦 Seahorse XF 分析探针板。将行标签(标有字母 A–D)放在左边。三角形缺口在左下角。
- 定位安捷伦 Seahorse XF 分析探针板。将行标签(标有字母 A–D)放在左边。三角形缺口在左下角。
- 将 A/D 上样导轨平面置于分析探针板顶部。定位上样导轨,使字母 A 位于左上角。上样时用指尖捏住上样导轨的外缘使之保持稳定,从而使移液吸头不会移动上样导轨。
- 使用量程为 10–100 µL 的多通道移液器,确保吸头牢固安装在移液器上。将移液吸头(填充加样化合物)放入上样导轨的目标列中,使吸头略微倾斜一定角度。在无阻力的前提下,将吸头尽可能插入孔中并排出化合物。请勿用强力将吸头完全插入孔中。
- 使用多通道移液器,确保吸头牢固安装在移液器上。将移液吸头(填充加样化合物)倾斜 45°。将吸头一半放入加药口,吸头的斜角抵在加药口的另一面。
- 请勿将吸头完全插入加药口底部,否则可能会导致化合物通过加药口泄漏。
- 缓慢向加药口中排出化合物。小心从加药口移走吸头,在整个操作过程中,使上样导轨保持稳定。


- 缓慢向加药口中排出化合物。小心从加药口移走吸头,在整个操作过程中,使上样导轨保持稳定。
- 避免产生气泡,请勿敲击探针板的任何部位试图缩小气泡。敲击可能使溶液从加药口泄漏。
- 切换到 B/C 上样导轨。将字母 B 定位在左上角。使用合适的上样导轨,对 B、C、D 加药口重复步骤 3–5 所述的上样过程。取下并丢弃上样导轨。
- 对 B、C、D 加药口重复上述步骤的上样过程。
- 目测加药口加样是否均匀。液体应在加药口中,确保探针板顶端无残余液滴。
加样基本信息和指南
- 推荐加样体积为 20–30 µL。
- 推荐加样体积为 50-100 µL。
- 加样后实现 10 倍稀释的推荐加样溶液体积,每个微孔板孔中已有 180 µL 检测液:
- 加药口 A:20 µL
- 加药口 B:22 µL
- 加药口 C:25 µL
- 加药口 D:28 µL
- 加样后实现 10 倍稀释的推荐加样溶液体积,每个微孔板孔中已有 500 µL 检测液:
- 加药口 A:55 µL
- 加药口 B:62 µL
- 加药口 C:69 µL
- 加药口 D:75 µL
- 根据实验设计选择加药口的组成、顺序和数量。
- 探针板上样时不建议使用自动移液器,因为可能使加样溶液从加药口泄漏。
- 如果需要进行不同类型的 XF 分析,请参阅相应的 XF 试剂盒用户指南。
- 探针板上样时不建议使用自动移液器或凝胶移液吸头。
相关支持材料
- 安捷伦 Seahorse XFe96 传感器探针板加药口加样
- 安捷伦 Seahorse XFe24 传感器探针板加药口加样
- 安捷伦 Seahorse XF24 传感器探针板加药口加样
- 安捷伦 Seahorse XFp 传感器探针板加药口加样
- 细胞表征:XFe96/XF96 分析仪和 Seahorse XF 实时 ATP 速率测定
- 细胞表征:XFe24 分析仪和 Seahorse XF 实时 ATP 速率测定
- XF24 细胞表征:XF24 分析仪和细胞能量代谢表型测试
- 细胞表征:XFp 分析仪和 Seahorse XFp 实时 ATP 速率测定
- 细胞表征:XF HS Mini 分析仪和 XF 实时 ATP 速率测定
- 细胞表征:采用 XF HS Mini 分析仪、HS 迷你板进行 XF 实时 ATP 速率测定
参考资料
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 分析指南和模板
- 安捷伦 Seahorse 模板
- 安捷伦细胞分析出版物数据库
浏览使用安捷伦细胞分析数据的出版物的完整列表。

仅显示 Seahorse Seahorse XF Pro 的信息
更改仪器类型4. 运行 XF 分析
本部分重点介绍使用 XF 实时 ATP 速率测定在分析仪上进行细胞初始表征。
本部分重点介绍使用细胞能量代谢表型测试在分析仪上进行细胞初始表征。
本部分重点介绍使用 XF 实时 ATP 速率测定在 XF HS Mini 分析仪上进行细胞初始表征。如需了解有关如何执行分析的详细信息,请参阅 XF HS Mini 用户指南。
重要事项 — 在开始 XF 分析之前
- 目测加药口加样是否均匀。液体应在加药口中,确保传感器探针板顶端无残余液滴。
- 在显微镜下观察细胞:
- 确定细胞健康状况、形态、接种均匀度和纯度(无污染)。
- 对于贴壁细胞,确保细胞贴壁形成均匀单层,清洗步骤中不会被冲走。
- 对于悬浮细胞,确保细胞在离心、清洗和培养后稳定附着。
- 确保背景孔不含细胞。
运行分析的流程
- 进入 XFe 分析仪,确保其通电并连接到 XFe 控制器(计算机)。您可以在 Wave 控制器软件左下角的小组件面板中确认仪器连接状态。
- 确保 XF Pro 分析仪通电并连接到 XF Pro 控制器软件。您可以在 XF Pro 控制器软件左下角的小组件面板中确认仪器连接状态。确认已显示温度。
- 从 Templates(模板)视图中双击打开所需的检测模板文件。如果您的检测模板未显示在“模板”视图中,使用共享网络驱动器或 U 盘传输模板。

- 检查组定义、板布局和仪器方案后,点击 Start Run(开始运行)。

- 输入结果文件的保存位置后(完成分析后),XFe 分析仪上的托盘门将打开。
重要!在开始校准前,应确保:
- 传感器探针板正确安装在水化板上。
- 取下传感器探针板的盖子。
- 传感器探针板在水化板上的位置经过正确定位(定向)。
- 输入结果文件的保存位置(完成检测后)并单击“保存”后,将打开“Load Cartridge”(探针板上样)窗口。确认“I’m Ready”(准备完毕)后,将打开 XF Pro 分析仪的托盘门。
重要!在开始校准前,应确保:
- 传感器探针板正确安装在水化板上。
- 取下传感器探针板的盖子。
- 传感器探针板在水化板上的位置经过正确定位(定向)。
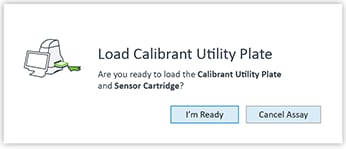
- 提示时,将传感器探针板(已水化并加载化合物)和水化板放在托盘上。
- 按 I'm Ready(准备完毕)启动传感器探针板校准。
完成校准大约需要 10–20 分钟(37 °C 下的分析)。对于在 37 °C 以外温度条件下的 XF 分析,需要额外加 30 分钟进行预校准,确保得到准确的数据。
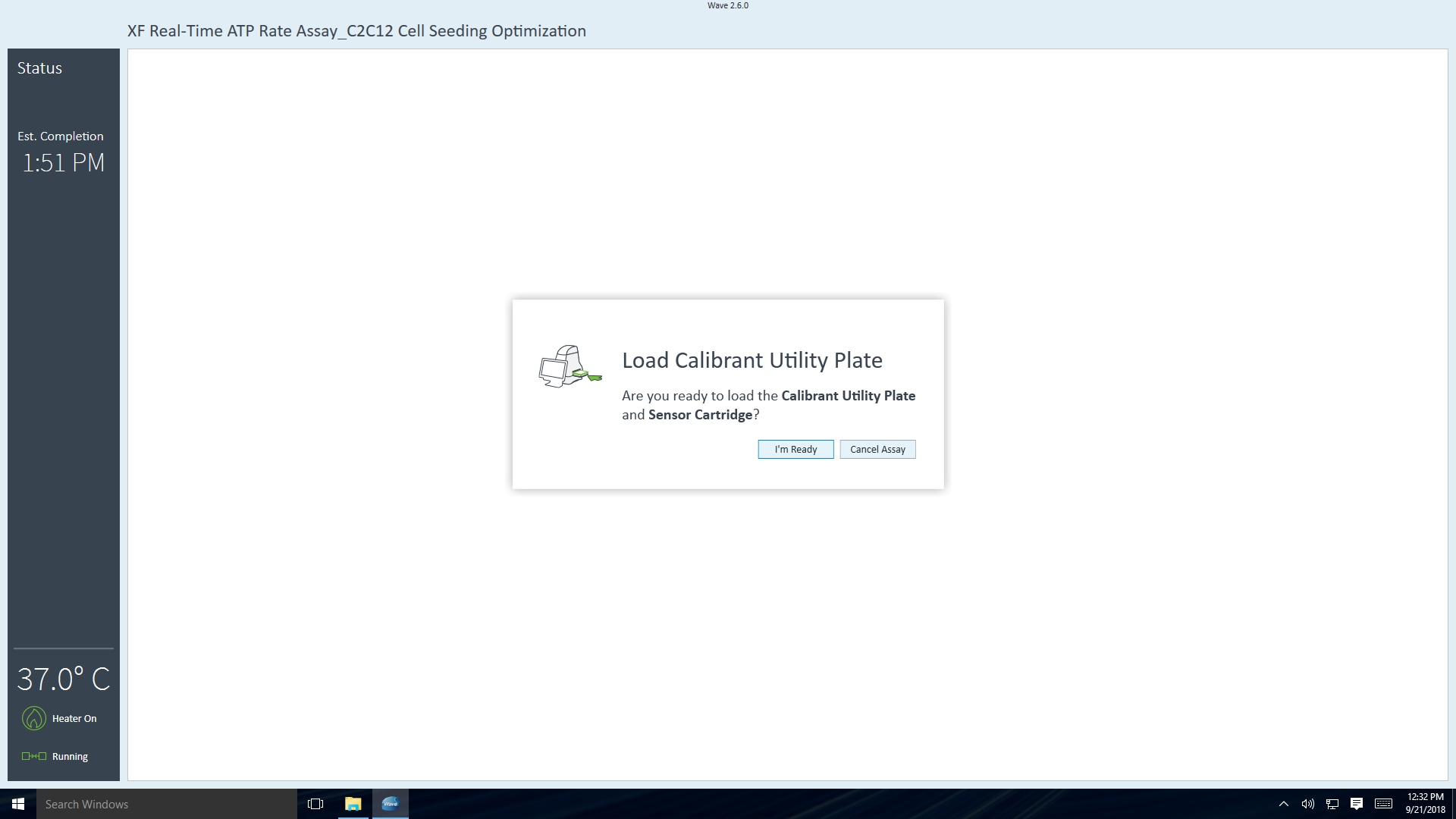
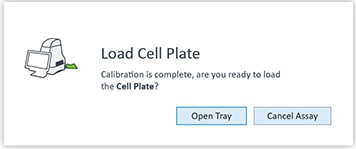
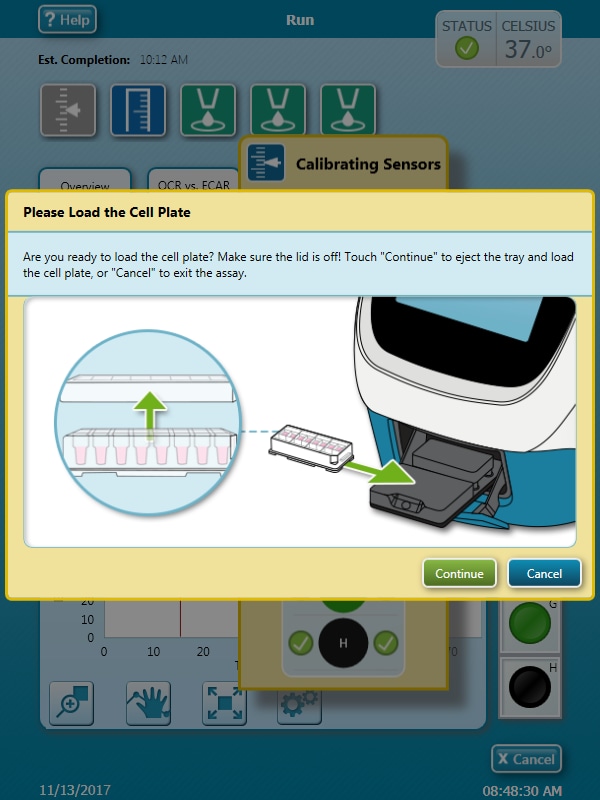
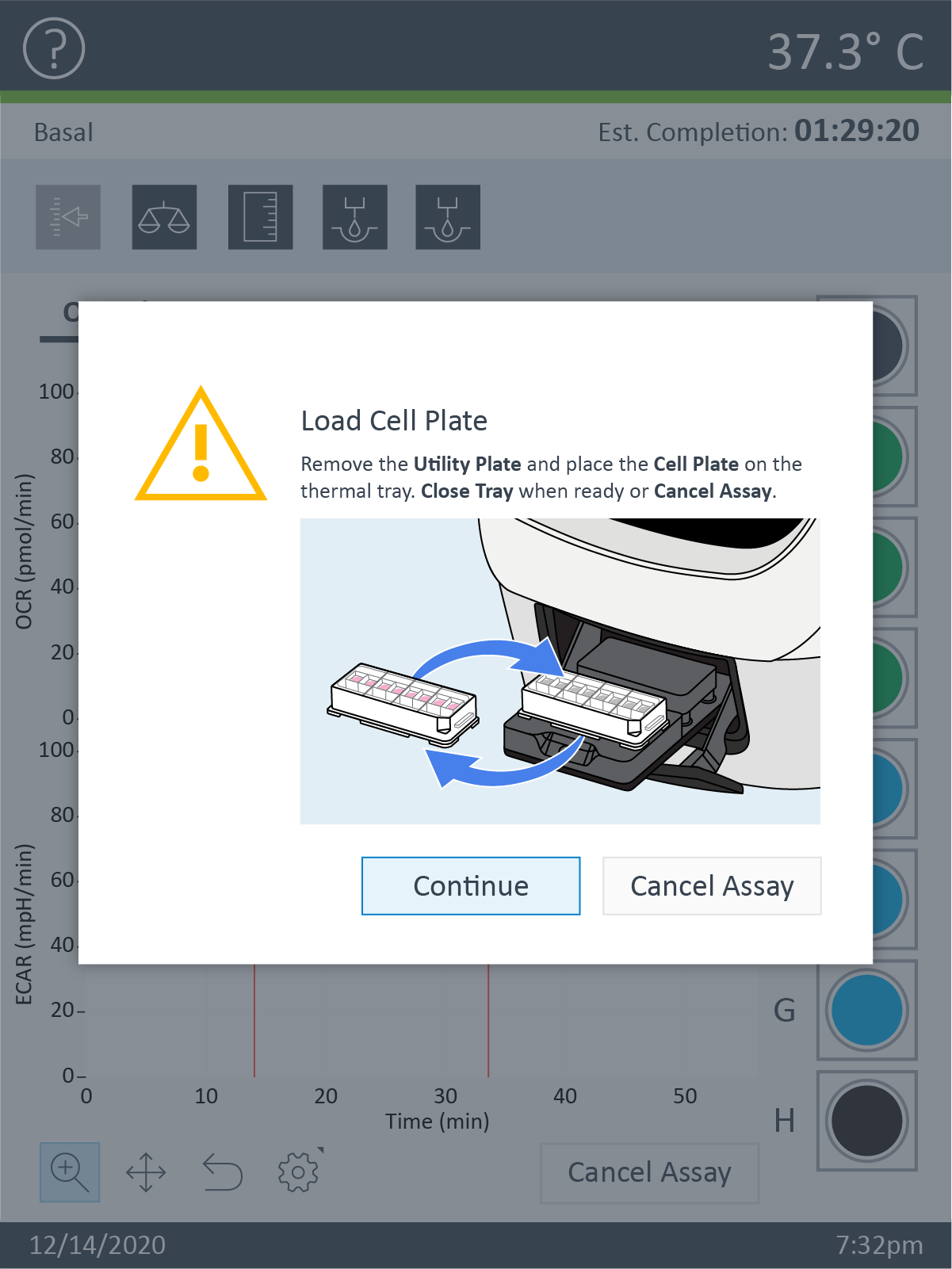
传感器探针板校准完成后,Wave 控制器将显示 Load Cell Plate(加载细胞板)对话框。 - 按 Load Cartridge(探针板上样)启动探针板校准流程。
完成校准大约需要 10-20 分钟(37 °C 下的检测)。对于在 37 °C 以外温度条件下的 XF 分析,需要额外加 30 分钟进行预校准,确保得到准确的数据。
探针板校准完成后,Wave 控制器将显示 Load Cell Plate(加载细胞板)对话框。
@2x%20350x472.png)
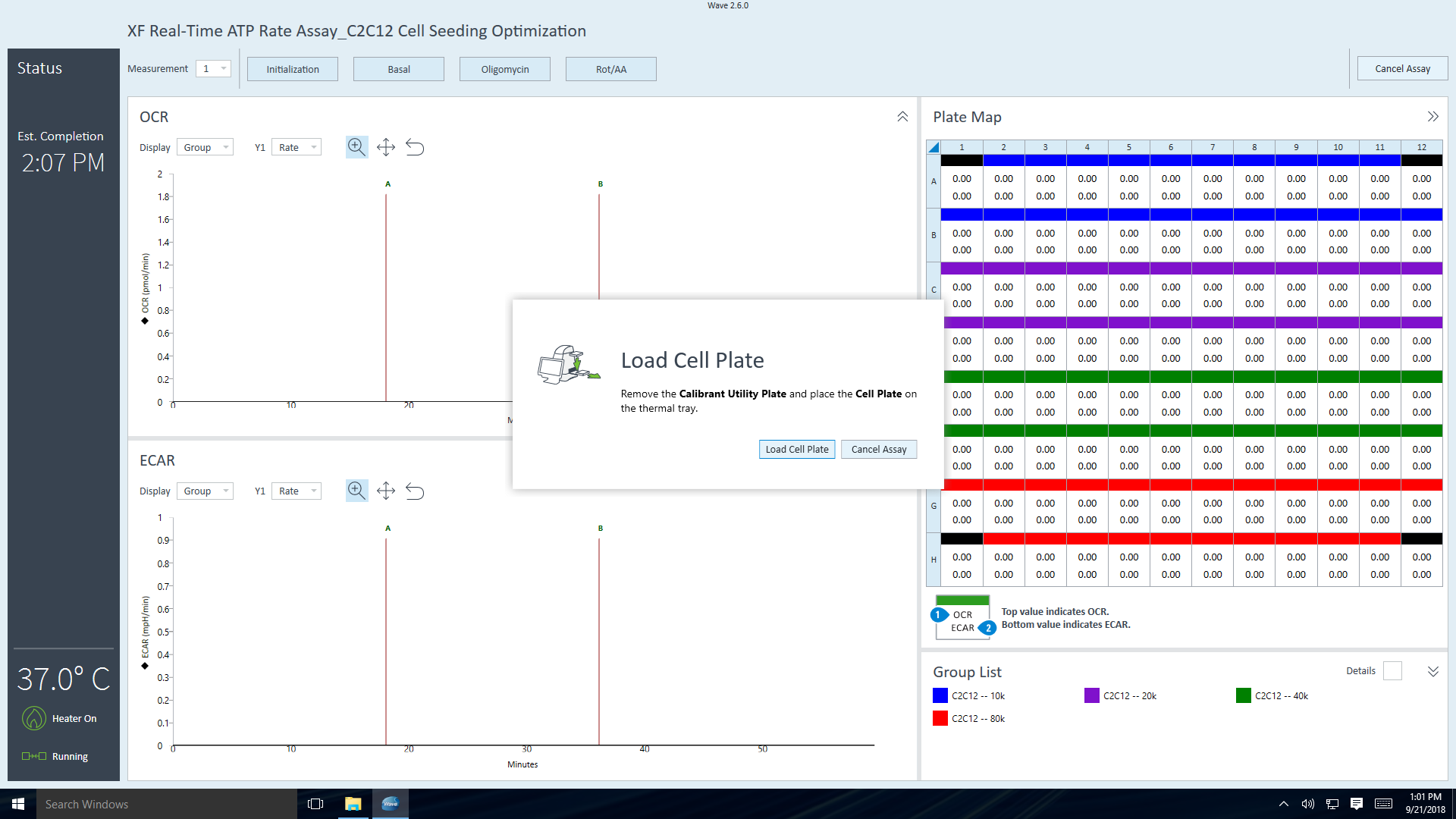
- 单击 Open Tray(打开托盘)弹出水化板,并将细胞板加载到托盘上。运行该步骤时,传感器探针板仍然在 XFe 分析仪中。
重要!在加载细胞板前,应确保:
- 取下细胞板的盖子。
- 细胞板在托盘上的位置经过正确定位(定向)。
- 单击 Open Tray(打开托盘)弹出水化板,并将细胞板加载到托盘上。运行该步骤时,探针板仍然在 XF Pro 分析仪中。
重要!在加载细胞板前,应确保:
- 取下细胞板的盖子。
- 细胞板在托盘上的位置经过正确定位(定向)。
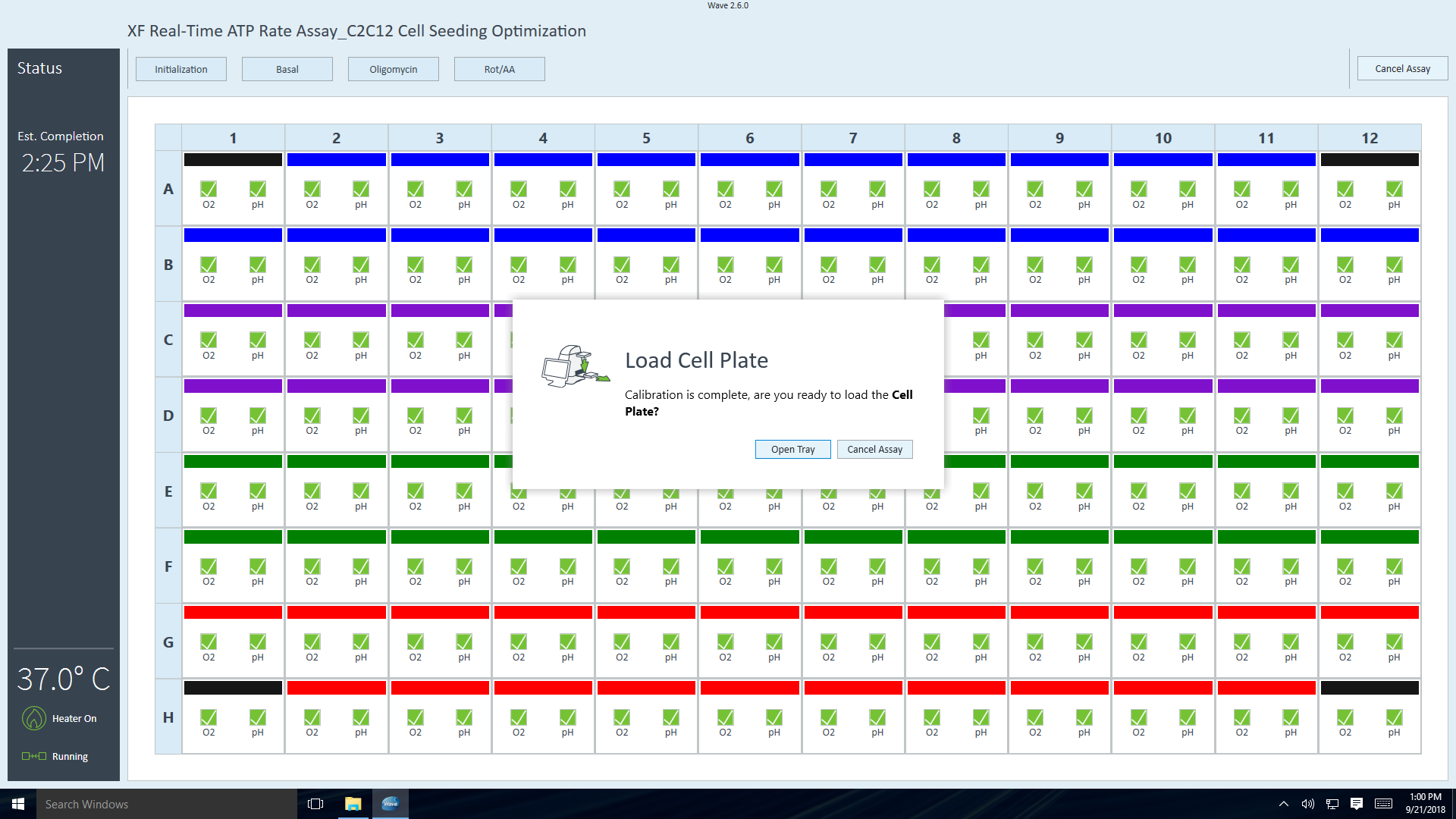
- 在将细胞板放在托盘上之后,点击 Load Cell Plate(加载细胞板)开始平衡。在完成平衡后,仪器将自动开始采集基线测量值(如仪器方案中所述)。
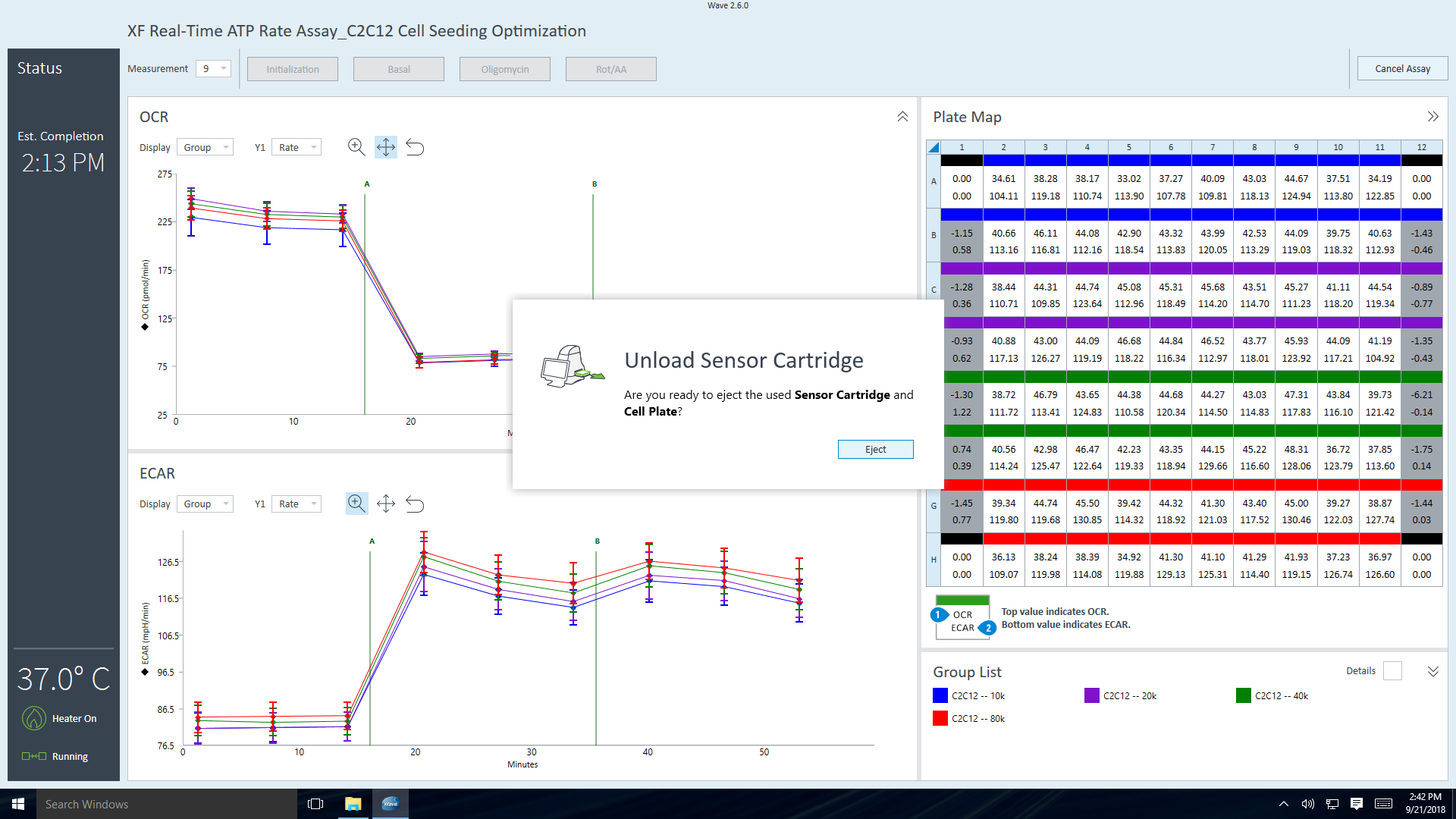
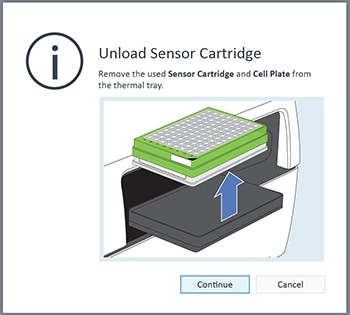
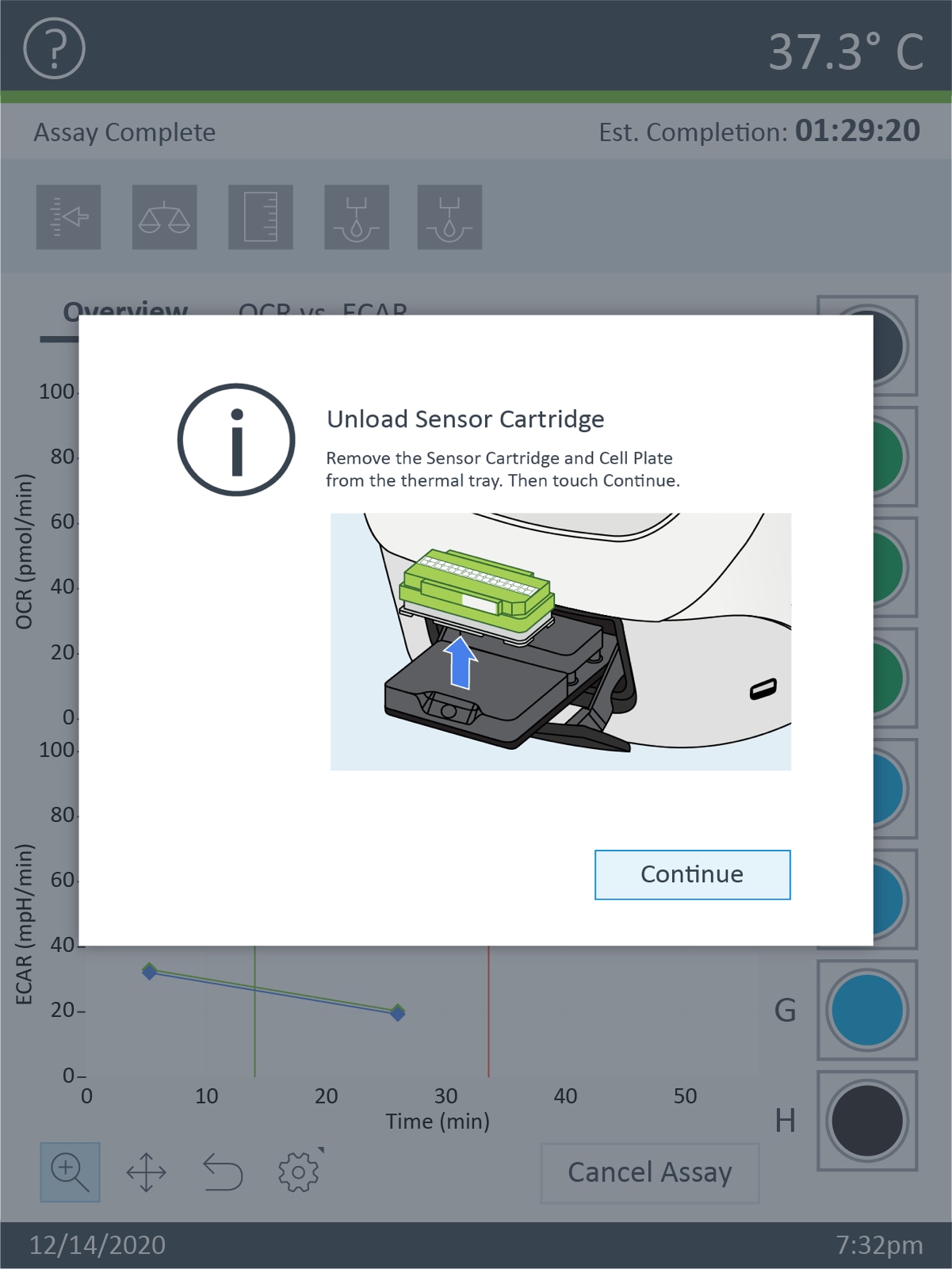
- 仪器方案的最终测量命令完成后,Wave 控制器软件将显示 Unload Sensor Cartridge(卸载传感器探针板)对话框。
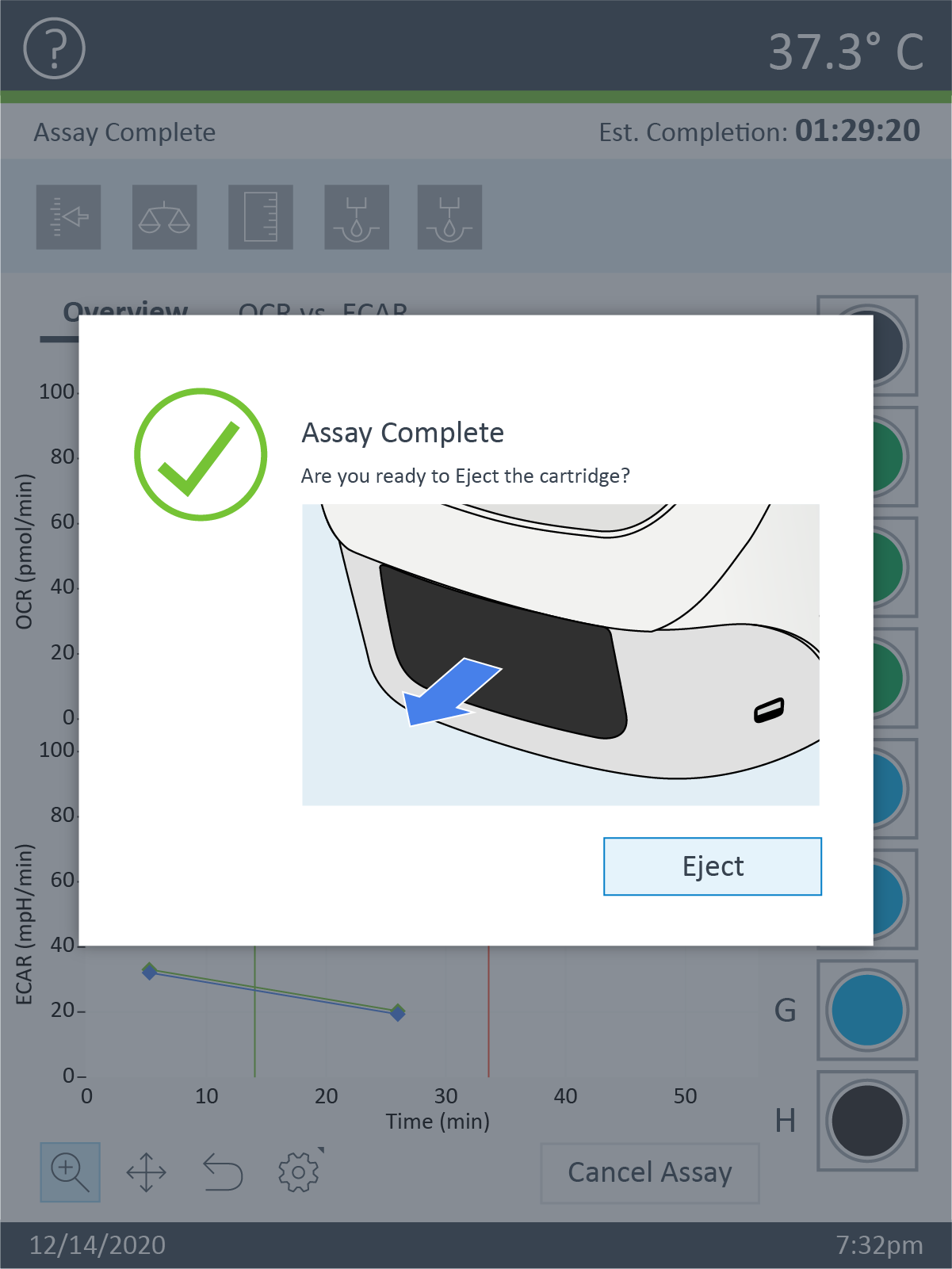
- 仪器方案的最终测量命令完成后,XF Pro 控制器软件将显示 Unload Sensor Cartridge(取下探针板)对话框。准备好弹出探针板和细胞板时,单击 EJECT(弹出)。如有需要可以将其保存,待后续分析(如细胞计数归一化)。

- 准备好弹出传感器探针板和细胞板时,单击 Eject(弹出)。如有需要可以将其保存,待后续分析(如细胞计数归一化)。
- 从托盘中取出传感器探针板和细胞板后,单击 Done(完成)。
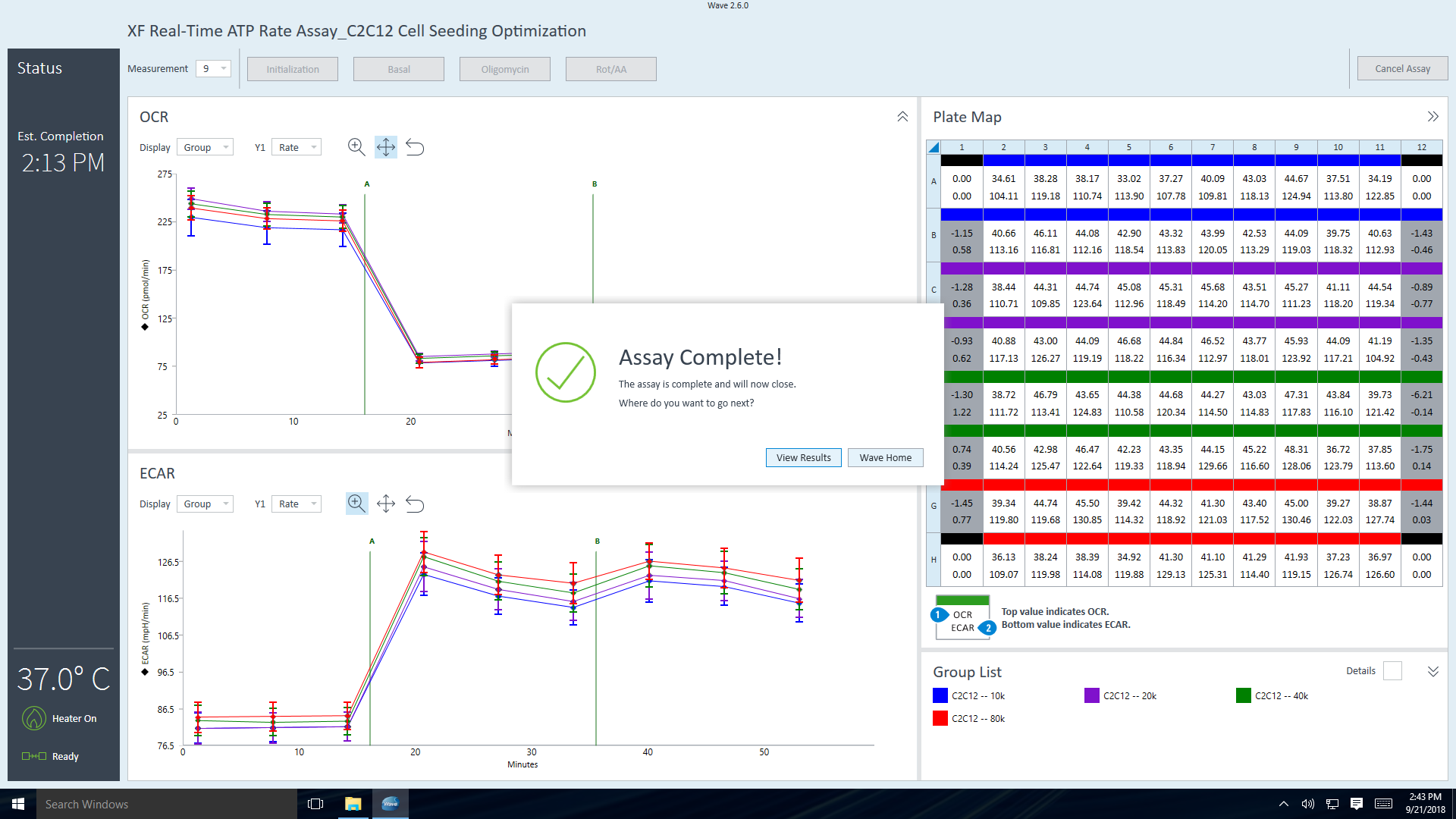
- 取出传感器探针板和细胞板后,将显示 Assay Complete(检测完成)对话框。
单击 View Results(查看结果)可以快速打开分析结果文件,或单击 Wave Home(Wave 主页)返回“模板”视图并开始另一个 XFe 分析。 - 软件将显示 Assay Complete(检测完成)对话框。单击 View Results(查看结果)可以快速打开分析结果文件。
- 保存分析结果文件或将其传输到共享网络驱动器或 U 盘上,并使用您电脑上的 Wave Desktop 软件打开用于数据分析。
- 保存分析结果文件或将其传输到共享网络驱动器或 U 盘上
参阅 Wave 用户指南第 2 章,了解 XFe 分析仪分析操作的完整细节,包括如何在分析中添加/删除测量值、XFe 分析在 37 °C 以外温度下的环境条件,等等。
参阅 Wave Pro 和 XF Pro 控制器软件用户指南了解详细信息,包括如何在检测过程中添加/删除测量点、XFe 分析在 37 °C 以外温度下的环境条件要求,等等。
运行分析的流程
- 填充所有目标加药口后,将探针板和水化板转移到分析仪上,并开始探针板校准。
重要!在开始校准前,应确保:
- 传感器探针板正确安装在水化板上。
- 取下传感器探针板的盖子。
- 传感器探针板在水化板上的位置经过正确定位(定向)。
- 探针板校准完成后,按照软件提示将水化板更换为细胞培养板并开始 XF 分析。
重要!在加载细胞板前,应确保:
- 取下细胞板的盖子。
- 细胞板在托盘上的位置经过正确定位(定向)。
- 检测完成后将弹出传感器探针板和细胞培养板,如有需要可以将其保存,待后续分析(如细胞计数归一化)。
- 将 XFd 结果文件保存或传输到共享网络驱动器或 U 盘上,并使用您电脑上的 Wave Desktop 软件打开用于分析数据分析。
运行分析的流程
- 在 XFp 分析仪主屏幕上,点击 Start(开始)显示可用的检测模板列表。

如果所需模板未在 Local(本地)选项卡列出,则使用共享网络驱动器或 U 盘打开或传输模板文件。
- 在 XF HS Mini 分析仪主页视图上,点击 Start(开始)显示可用的检测模板列表。
- 如果所需的检测模板文件在 Wave Pro/Wave 软件或 Seahorse Analytics 上创建,则分别使用共享网络驱动器或 U 盘打开或传输检测模板文件。
- 点击以打开检测模板查看模板设计:
- 组定义 — 点击组名显示所选组的加样策略、预处理和细胞类型信息。XFp 分析仪软件不允许修改组定义,修改必须使用 Wave Desktop 软件。
- 板布局 — 改变分配到组的某个孔,先点击组名称,然后点击板布局上的孔。
- 点击列表中的模板,打开并检查组定义和板布局:
- 组定义 — 点击组名显示所选组的加样策略、预处理、检测液和细胞类型。可以使用安捷伦 Seahorse Analytics 的“修改”功能修改组定义。
- 板布局 — 要改变板布局上分配给某个孔的组,先点击列表中的组名称,然后点击板布局上的孔。
- 点击向右的箭头(右下角)查看或编辑仪器方案
- 如需在仪器方案中添加或删除测量周期,首先点击“实验步骤”,然后使用加/减按钮调整测量周期。
- 点击 XF HS Mini 显示屏顶部功能区中的 Protocol(方案)以查看或编辑仪器方案。
- 如需添加或删除测量周期,首先点击 Protocol(方案)命令,然后使用加/减按钮调节测量周期的数量。
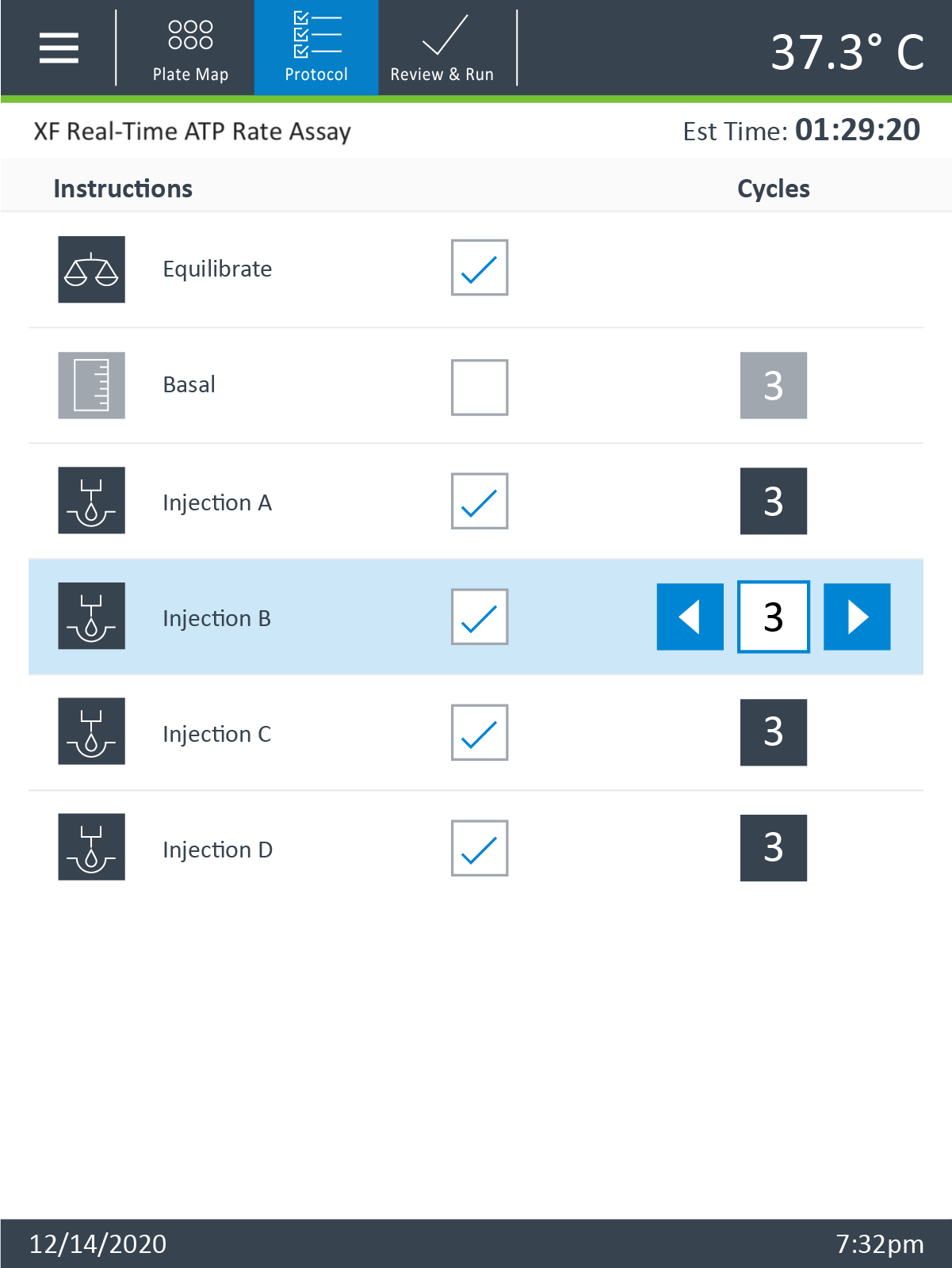
- 点击向右的箭头(右下角)查看或编辑仪器方案。
- 点击 Assay Name(分析名称)旁的 Edit(编辑),自定义分析结果文件名称。
- 点击 Notes(备注)旁的 Edit(编辑),添加与分析相关的自定义备注。
- 点击 Email Notification(邮件通知)旁的 Edit(编辑),将用户交互通知收件人(例如用细胞板替换水化板),并在检测完成后自动发送分析结果文件。该功能需要 XFp 分析仪器联网。
- 点击 XF HS Mini 显示屏顶部功能区中的 Review & Run(查看和运行)可以:
- 编辑分析结果文件名。
- 添加关于分析的注释。
- 查看提醒通知。
- 输入电子邮件地址,以便在需要用户交互时接收来自 XF HS Mini 分析仪的自动通知,并在完成分析时接收分析结果文件的副本。此功能需要有效的网络连接。
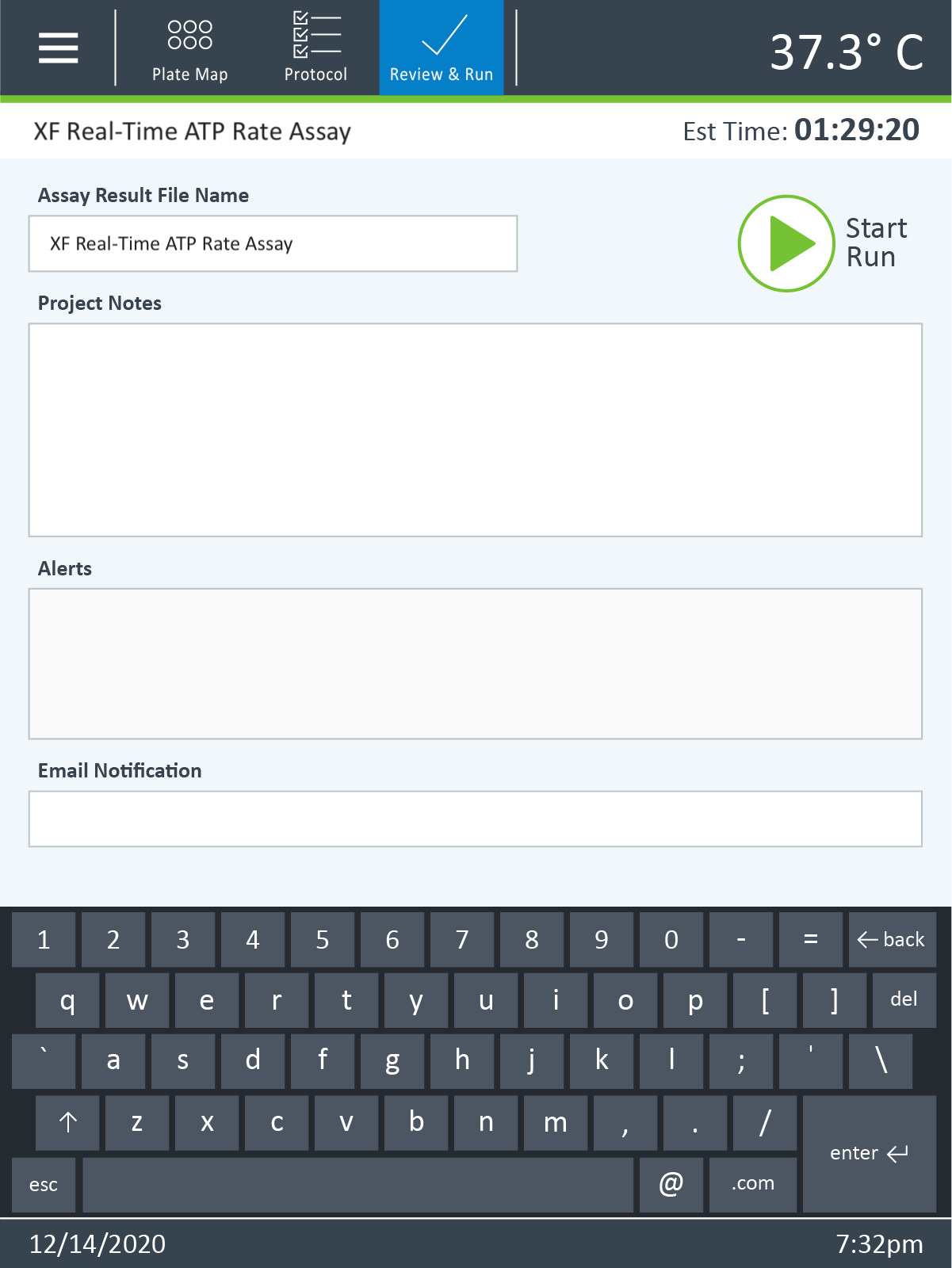
- 在准备开始 XF 分析时,单击 Start Assay(开始分析)。
- 提示时,将传感器探针板(已水化并加载化合物)和水化板放在托盘上。
重要!在加载细胞板前,应确保:
- 传感器探针板正确安装在水化板上。
- 取下传感器探针板的盖子。
- 传感器探针板在水化板上的位置经过正确定位(定向)。

- 准备好开始 XF 分析时,点击 Start Run(开始运行)。
- 按照屏幕上的提示加载校准液水化板和传感器探针板(已水化并加载用于加样的化合物)。
重要!在开始校准前,应验证:
- 传感器探针板正确安装在校准液水化板上。
- 传感器探针板的盖子已取下。
- 传感器探针板和校准液水化板正确放置在托盘上。
在准备开始校准时,点击 Close Tray(关闭托盘)。
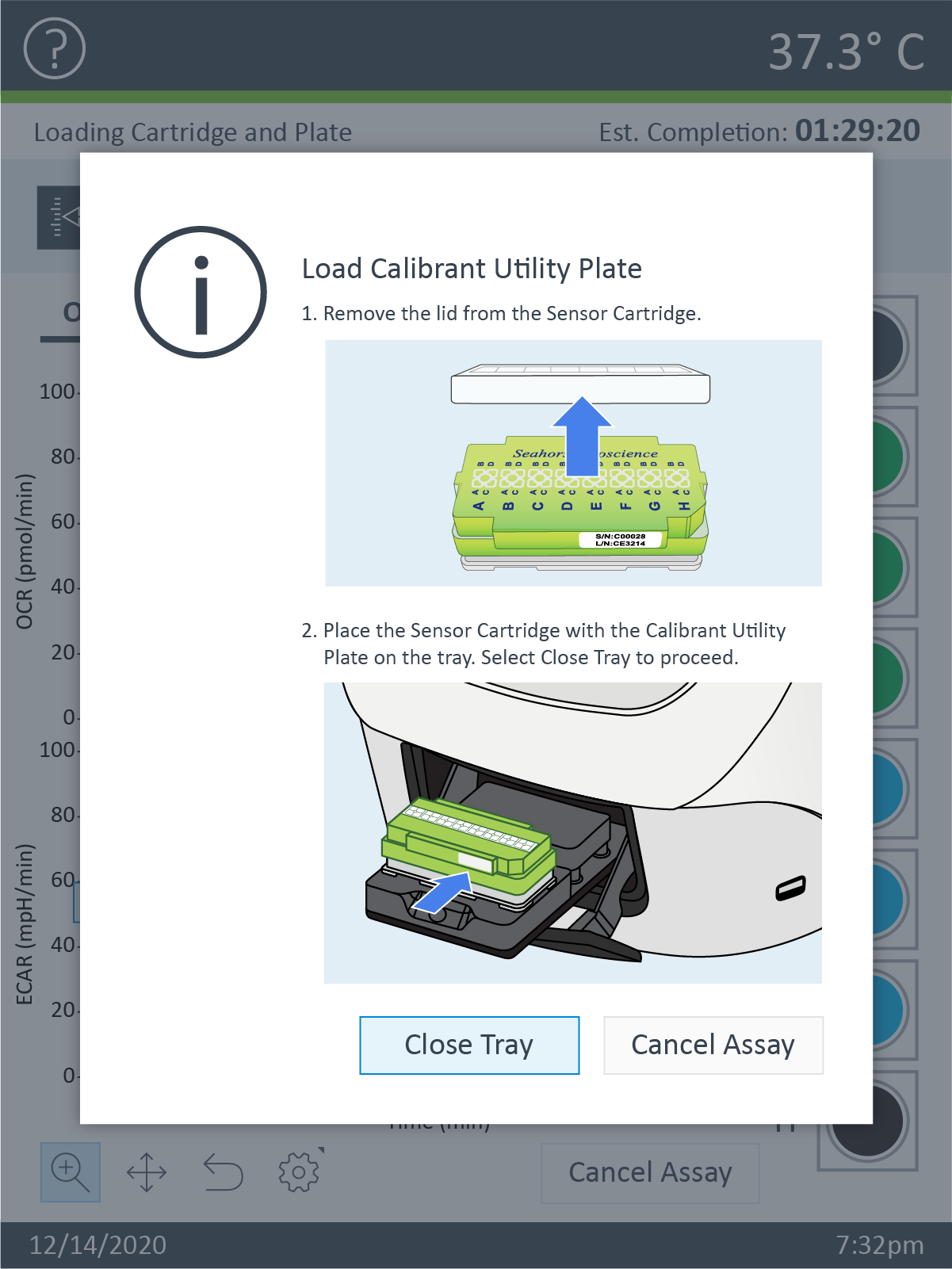
- 校准完成后,XFp 分析仪托盘将打开并露出水化板。取下水化板,将细胞板加载到托盘上。
重要!在加载细胞板前,应确保:
- 取下细胞板的盖子。
- 细胞板在托盘上的位置经过正确定位(定向)。
在准备开始分析时,点击 Continue(继续)。
- 校准完成后,点击 Open Tray(打开托盘)以露出校准水化板。取下校准水化板,将细胞板放到托盘上。
重要!在加载细胞板开始分析前,应验证:
- 细胞板盖子已取下。
- 传感器探针板和校准液水化板正确放置在托盘上。
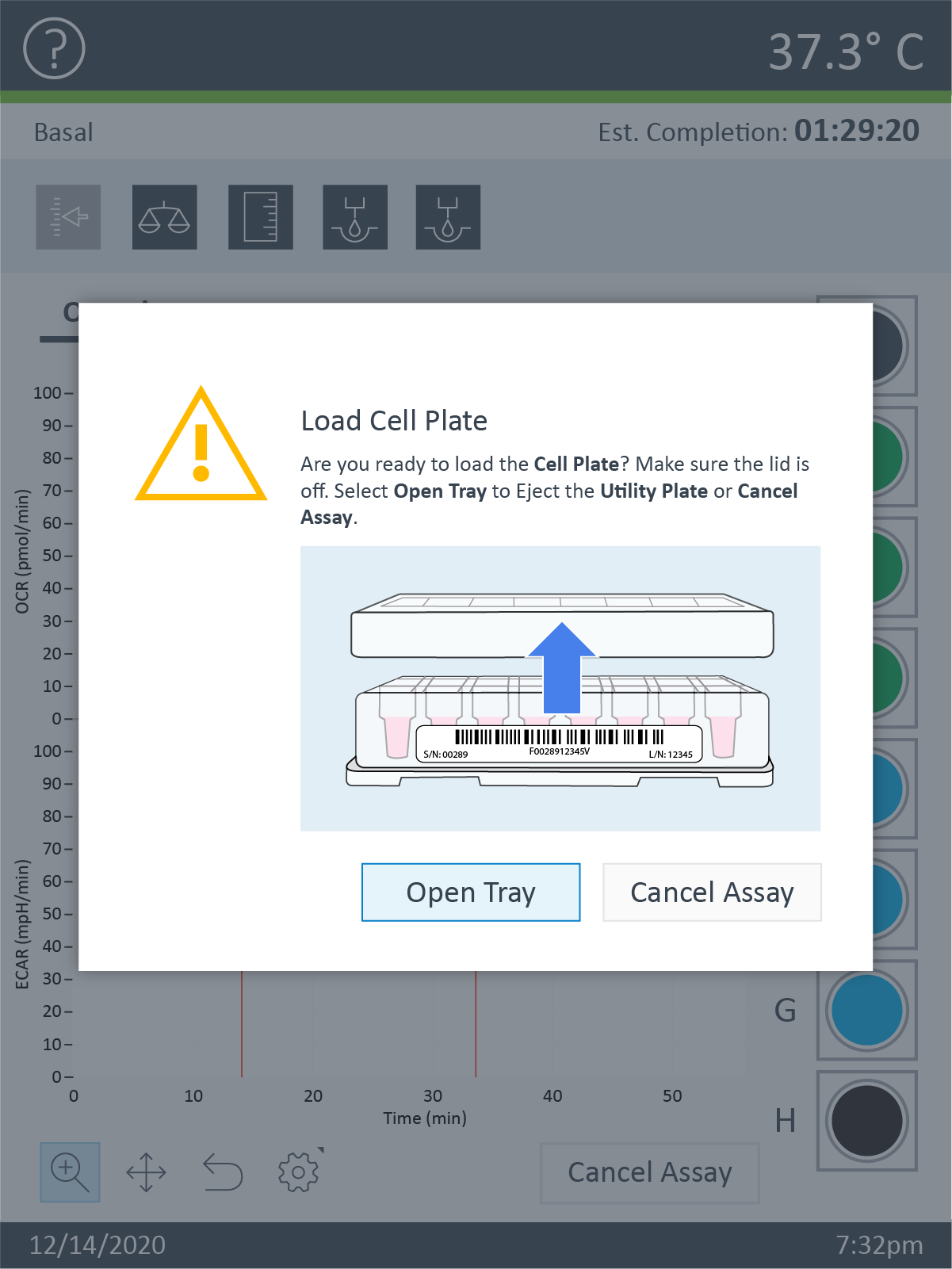
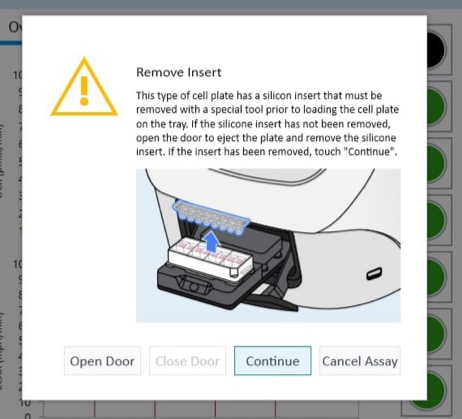
注:将 XF HS 迷你板加载到 XF HS Mini 分析仪时,屏幕上将显示一条提示,提醒您取下硅胶遮罩。必须取下遮罩,以防干扰和损坏仪器。
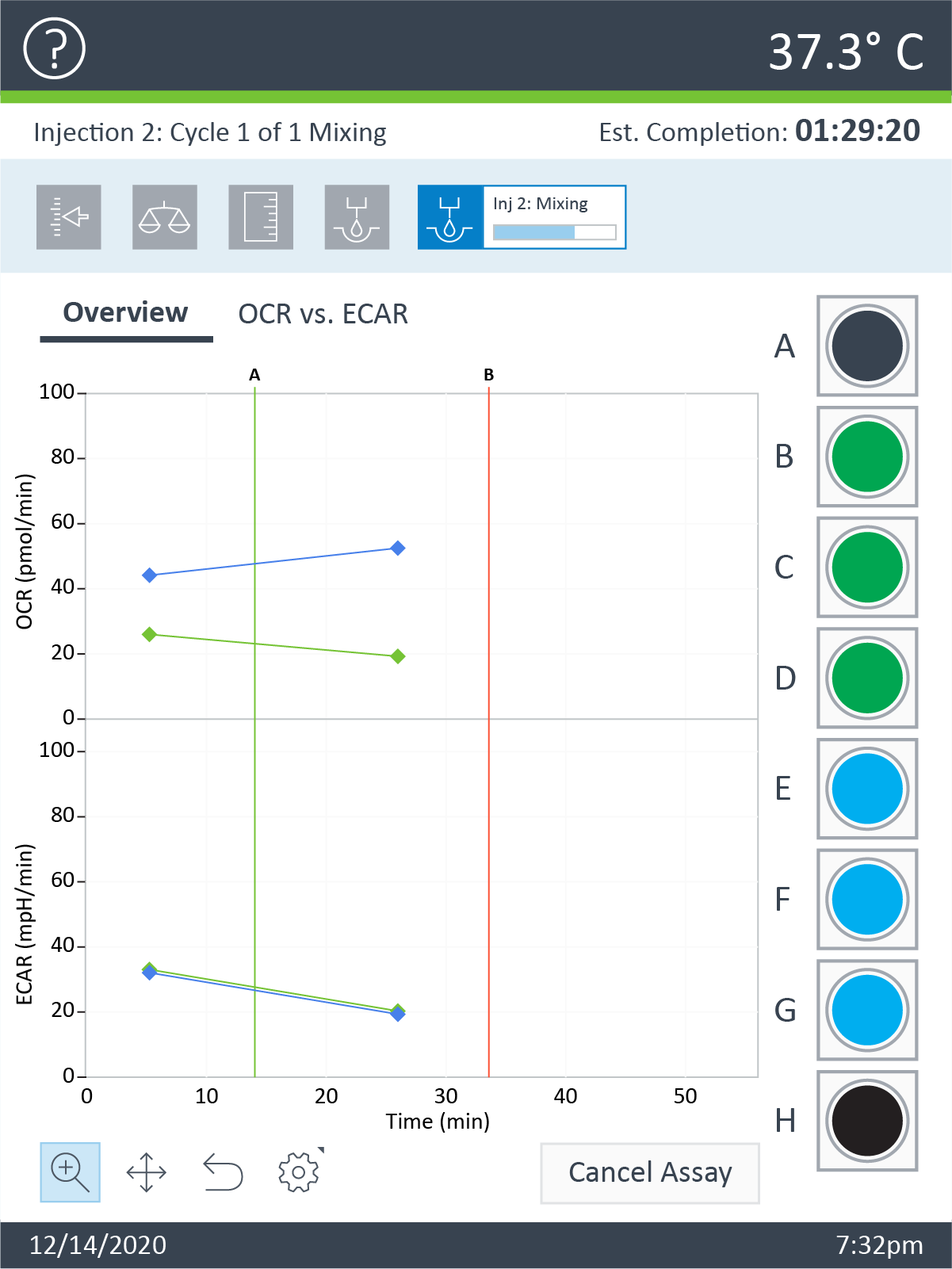
- 在将细胞板放在托盘上之后,点击 Continue(继续)开始平衡。在完成平衡后,分析将自动开始采集基线测量值(如仪器方案中所述)。
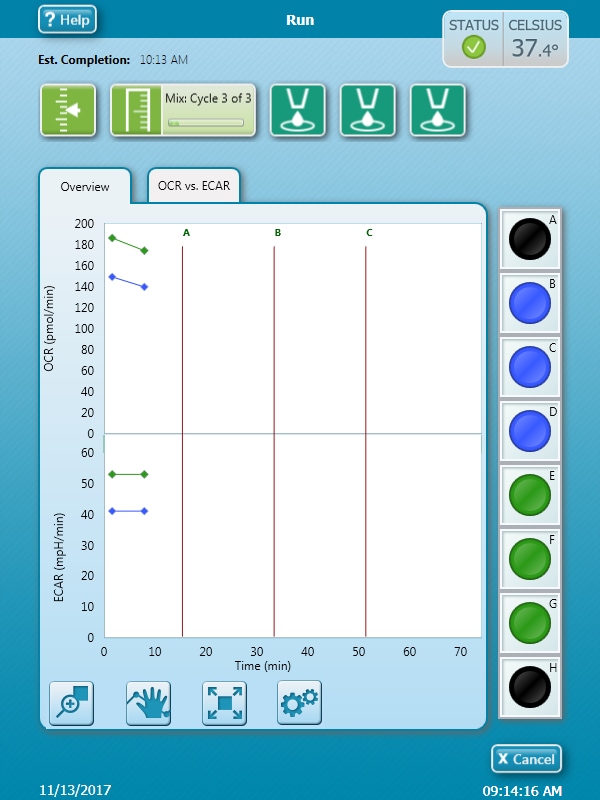
- 分析的第一步称为平衡。在完成平衡后,分析将开始采集第一个基线测量值(如仪器方案中定义)。在视图中心数据显示的上方,可以看到仪器方案中的当前命令和已完成的命令。
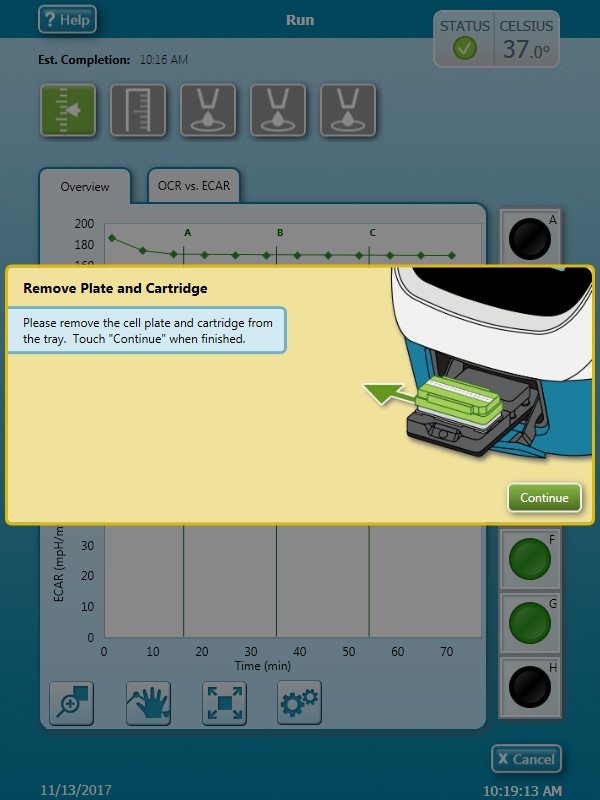
- 在仪器方案的最终测量命令完成后,将出现 Remove Plate and Cartridge(取下板和探针板)对话框。点击 Continue(继续)弹出传感器探针板和细胞板。如有需要可以将其保存,待后续分析(如细胞计数归一化)。
- 在仪器方案的最终测量完成后,点击 Eject(弹出),从 XF HS Mini 中弹出传感器探针板和细胞板。托盘完全弹出时,从托盘中取出传感器探针板和细胞板,如有需要可以将其保存,待其他分析(如细胞计数归一化)。点击 Continue(继续)关闭托盘。
- 保存分析结果文件或将其传输到共享网络驱动器或 U 盘上,并使用您电脑上的 Wave Desktop 软件打开用于数据分析。
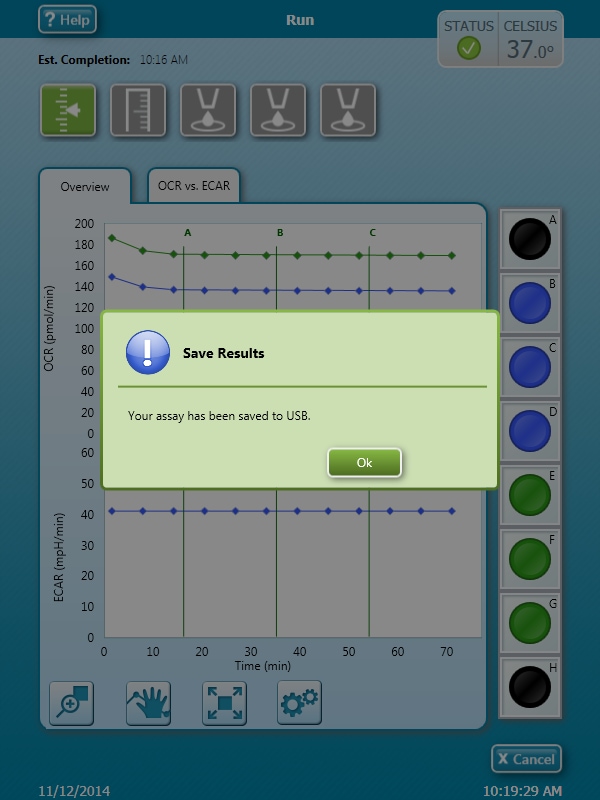
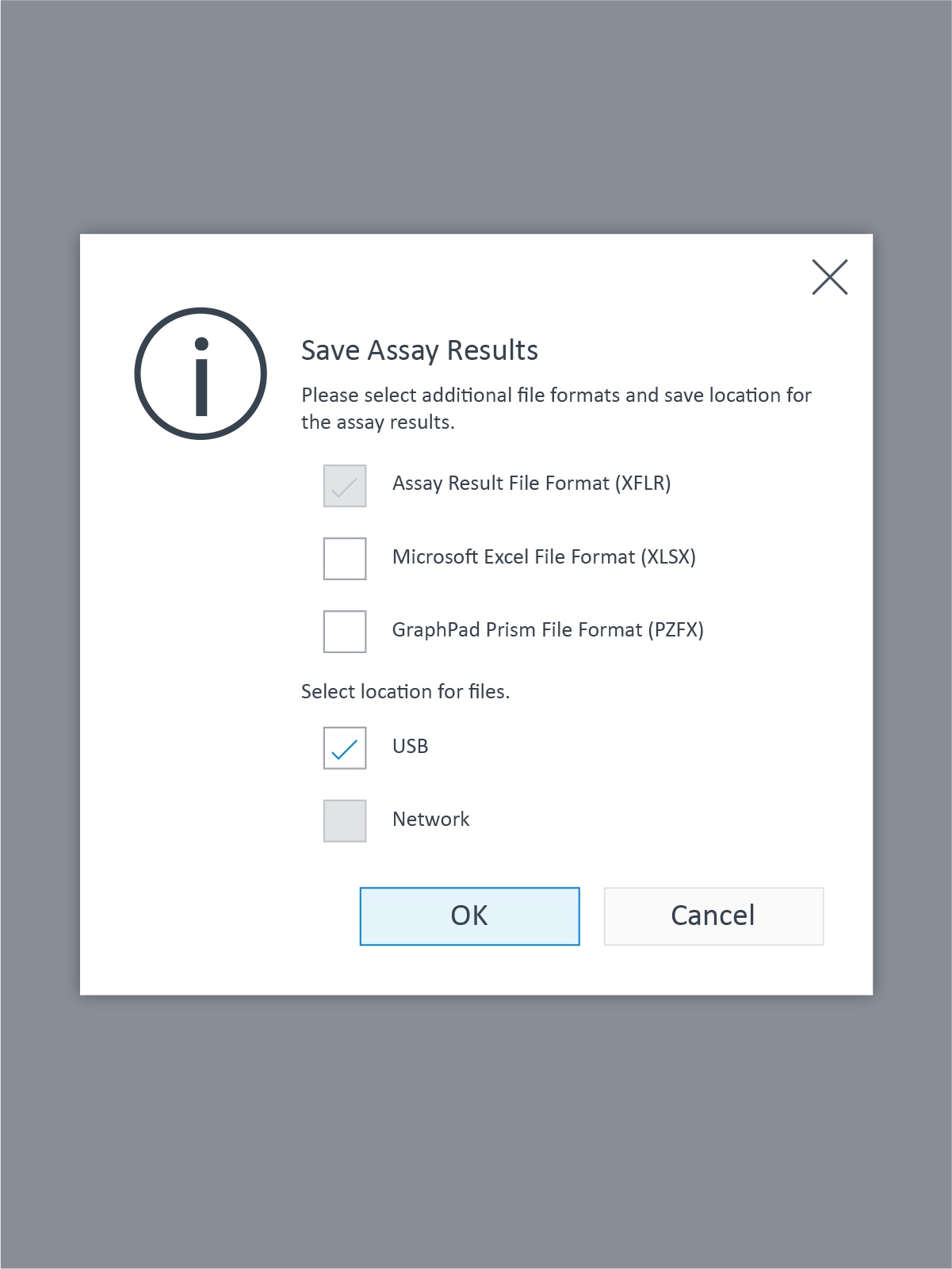
- 选择一个位置(USB 或网络)来保存 XF HS Mini 的分析结果文件和其他数据文件格式,然后点击 OK(确定)。登录您的 Seahorse Analytics 账户并上传您的 XF HS Mini 分析结果文件以进行数据分析。
相关支持材料
- XF24 软件下载
- XF96 软件下载
- 安装与故障排除指南
- XF24 软件自述文件安装指南
- XF96 软件自述文件安装指南
- XFp 细胞能量代谢分析仪用户指南
- XF HS Mini 细胞能量代谢分析仪用户指南
- XFp 网络设置指南
- XF HS Mini 网络设置指南
- Wave 用户指南
- XFe 网络指南
- 安捷伦 Seahorse XF 实时 ATP 速率测定模板
- 如何分析安捷伦 XF 实时 ATP 速率测定结果数据
- 技术概述:表征细胞 — 采用 OCR 值确定最佳接种密度
- 技术概述:表征细胞 — 采用 OCR 值确定最佳接种密度
- Seahorse XF HS Mini 软件更新(2021 年 2 月)
- 安捷伦 Seahorse XF Pro 分析仪操作手册
- 安捷伦 Seahorse Wave Pro 和 XF Pro 控制器软件用户指南

仅显示 Seahorse Seahorse XF Pro 的信息
更改仪器类型5. 分析 XF 分析结果
在分析 XF 分析结果部分,您将学习关于安捷伦 Seahorse Analytics 的基础知识,以及如何使用 Seahorse Analytics 分析您的 XF 实时 ATP 速率测定结果文件。虽然 Wave Pro、XF Pro 控制器和 Seahorse Analytics 软件均可用于分析结果,但 XF Pro 控制器和 Wave Pro 软件仅提供 Seahorse Analytics 中的部分分析功能。如果您正在寻找关于 XF Pro 控制器和 Wave Pro 软件的帮助内容,请点击此处。如果您正在寻找关于 Wave Desktop 和报告生成器的帮助内容,请点击此处。
Seahorse Analytics 是一款基于网页的软件应用程序,它提供桌面式互动,简便易学的界面,让您能够在全球任何地方通过任何计算机分析来自安捷伦 Seahorse XFe、XFp 和 XF HS Mini 分析仪的结果数据。只要您联网,就可以使用 Seahorse Analytics 分析您的 Seahorse 数据。
选择以下主题了解更多信息:
5.1 前言
5.1 前言和文件上传
安捷伦 Seahorse Analytics 是 Seahorse 分析仪分析仪的首选数据分析软件,可以轻松地导入、分析、报告结果,并与团队或合作者共享。
安捷伦 Seahorse Analytics 是一款基于网页的数据分析软件,适用于 Seahorse XF 分析仪,您能够通过任何一台联网的计算机轻松导入、分析和共享结果。
有关安捷伦 Seahorse Analytics 的基本信息:
| 性能指标 | 详细信息 |
|---|---|
| 用途 | 数据分析 |
| Seahorse 数据文件兼容性 | XFe96 分析结果文件 |
| XFe24 分析结果文件 | |
| XFp 分析结果文件 | |
| XF HS Mini 分析结果文件 | |
| 互联网浏览器兼容性 | Google Chrome |
| Safari | |
| Mozilla Firefox | |
| Microsoft Edge 强烈建议不要使用 Internet Explorer |
|
| 导出选项 | Microsoft Excel (.xlsx) |
| Graphpad Prism (.pzfx) | |
| 图像文件(.JPG 和 .PNG) |
| 性能指标 | 详细信息 |
|---|---|
| 互联网浏览器兼容性 | Google Chrome |
| Safari | |
| Mozilla Firefox | |
| Microsoft Edge 强烈建议不要使用 Internet Explorer |
|
| 导出选项 | Microsoft Excel (.xlsx) |
| GraphPad Prism (.pzfx) | |
| 图像文件(.JPG 和 .PNG) |
熟悉 Seahorse Analytics 用户界面
主页视图:
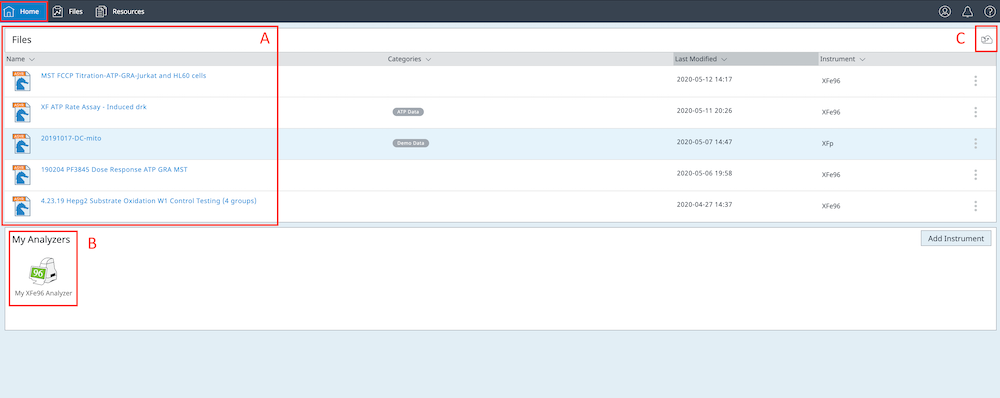
注册和/或登录 Seahorse Analytics 账户后,您将进入主页视图(如下图所示)。要返回主页视图,请点击深蓝色导航功能区左上角的 Home(主页)按钮。
- 主页视图上的数据文件列表显示您从文件共享中导入、编辑和/或接受的五 (5) 个最新文件。
- 在文件列表下方,您将看到 My Analyzers(我的分析仪),您可以在其中将一个或多个 Seahorse XF 分析仪关联到您的账户。
- 要从主页视图中导入数据文件,请点击文件列表上方右上角中的 File Upload(上传文件)小按钮。
文件视图:
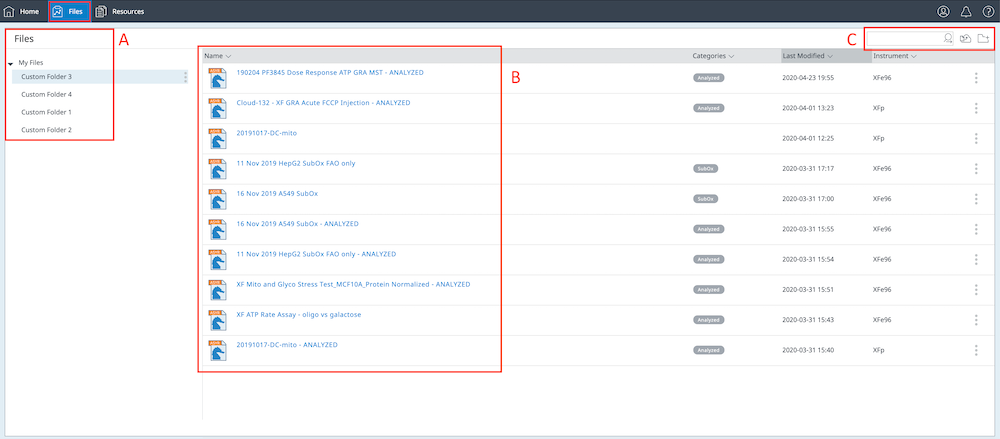
点击应用程序顶部深蓝色功能区左上角的 Files(文件)按钮,以显示已导入您的 Seahorse Analytics 账户的所有数据文件。
- 在文件视图的左侧,您将看到为您的账户创建的任何自定义文件夹。
- 文件列表和随附的文件元数据(即最近修改日期、仪器类型等)显示在文件视图的中间。
- 在文件视图的右上角,可以看到 File Upload(上传文件)按钮,用于将数据文件导入您的账户。您会看到 Create Folder(创建文件夹)按钮,该按钮可以创建一个新的自定义文件夹,您可以向其分配数据文件。您还会看到一个搜索字段,允许您对账户中的数据文件执行关键字搜索。搜索功能可在文件名、类别、最近修改日期和仪器类型中查找关键字匹配。
资源视图:
点击顶部深蓝色功能区中的 Resources(资源),访问一系列常用资源,以支持您的安捷伦 Seahorse XF 分析工作流程,并获取安捷伦细胞分析支持团队的联系信息。

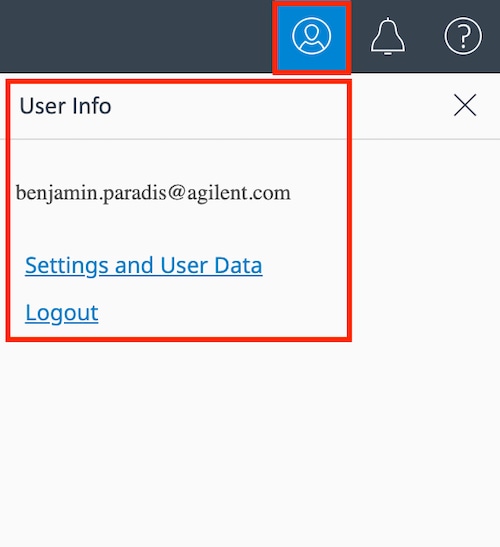
设置和用户信息:
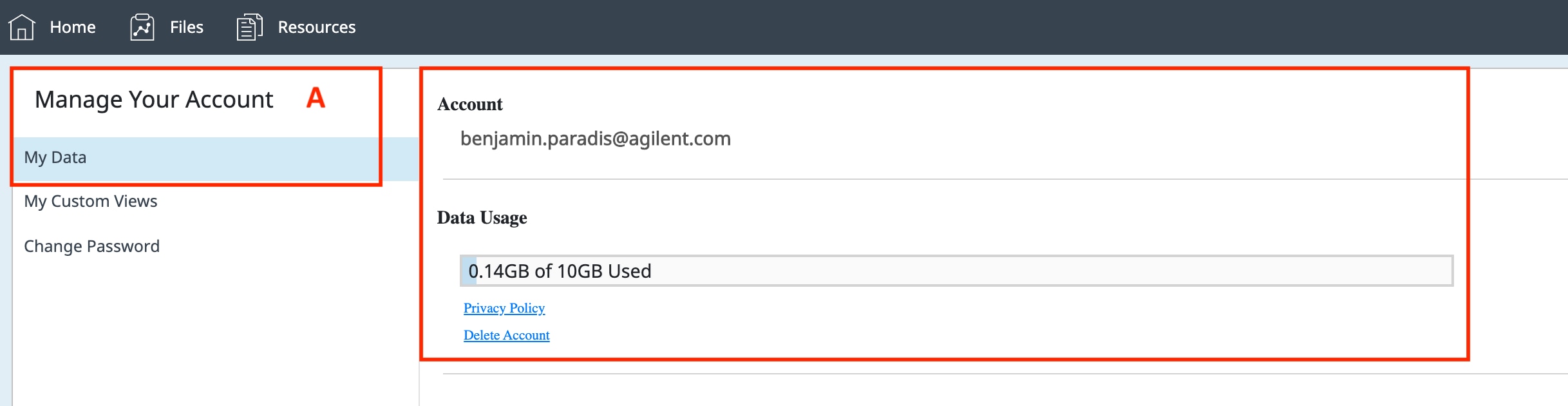
点击深蓝色顶部导航栏右上角的用户账户图标,以管理用户账户信息或注销。
点击 Settings and User Data(设置和用户数据)链接以显示账户管理选项,其中包括:
- 检查用于存储数据文件的可用空间,查看安捷伦隐私权政策,或删除您的 Seahorse Analytics 账户。
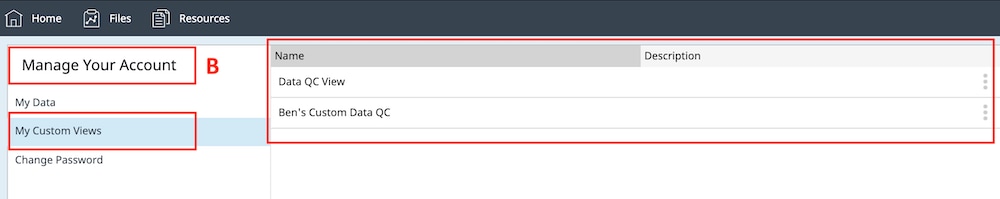
- 重命名或删除自定义分析视图。
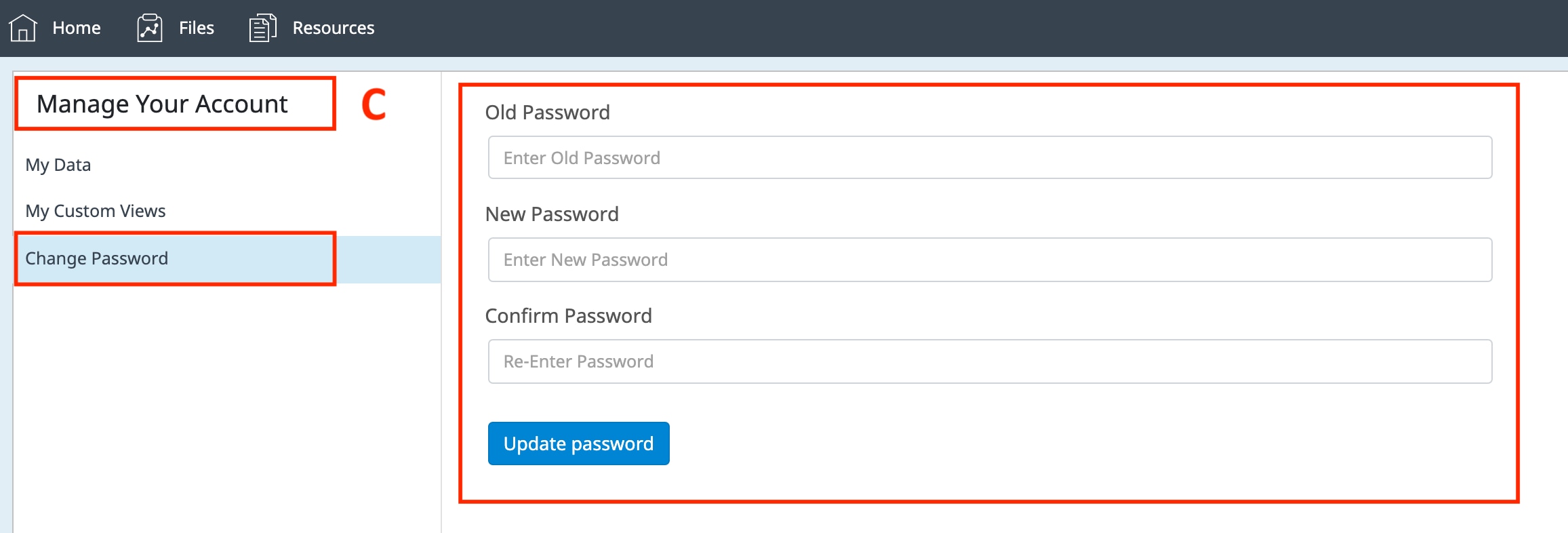
- 更改您的 Seahorse Analytics 账户密码。
通知:
点击深蓝色顶部导航栏右上角的小铃铛图标可以显示您的账户通知。您可以通过通知了解到何时某人与您共享了数据文件,或者您与其他用户共享的文件是否已被接受。通知铃铛图标将显示一个小红色数字,代表您的待处理通知数量。有关如何共享和接受数据文件的更多信息,请参阅共享部分。
帮助:
点击深蓝色顶部导航栏右上角的问号图标可以显示基本帮助信息。点击 Help(帮助)按钮时,显示的帮助信息取决于软件的当前屏幕。有关分析视图的更多信息,请在分析视图上点击 Help(帮助)按钮。有关文件管理功能的更多信息,请在文件视图上点击 Help(帮助)按钮。
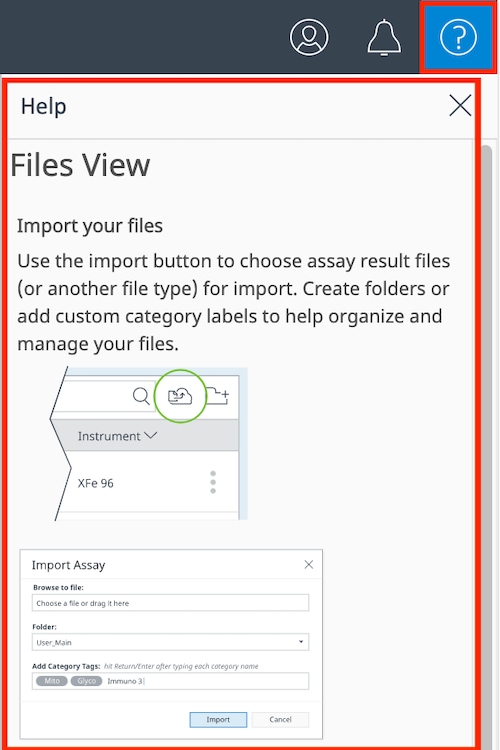
如何导入数据文件
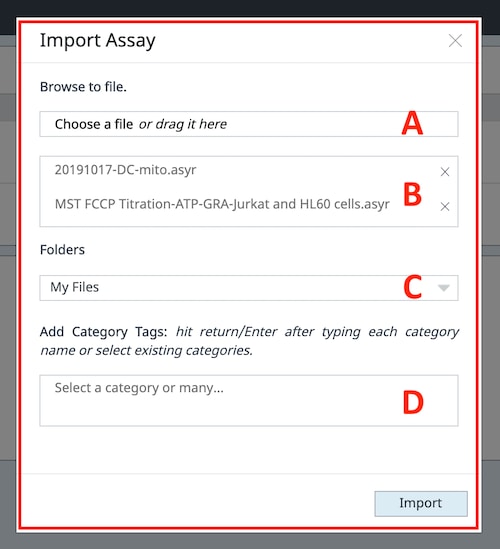
有两种方法可将数据文件导入到您的账户中:(1) 手动导入数据文件,或 (2) 接受与您共享的数据文件。您可以在主页和文件视图上,使用两个视图文件列表上方右上角的“上传文件”按钮,将数据文件导入到您的账户中。
- 单击 File Upload(上传文件)按钮,显示文件上传对话框(如右图)。
- 单击 Choose a file(选择文件)以浏览数据文件,或者,如果打开了数据文件的文件浏览器,则可以将文件拖放到该区域中。
- 一次导入一个或多个数据文件,可以看到已选择 2 个数据文件用于导入。
- 选择一个自定义文件夹来保存数据文件,而不是主文件列表。导入数据文件后,可以随时将其移动到自定义文件夹。
- 通过输入新类别或点击类别字段显示现有类别标签,为数据文件分配类别标签。
如何导入数据文件
有两种方法可将数据文件导入到您的账户中:(1) 手动导入数据文件,或 (2) 接受与您共享的数据文件。您可以在主页和文件视图上,使用上传文件按钮,将数据文件导入到您的账户中。
- 单击 Upload File(上传文件)按钮。
- 单击 Browse(浏览),或者,如果打开了数据文件的文件浏览器,则可以将文件拖放到该区域中。
- 一次导入一个或多个数据文件,可以看到已选择 2 个数据文件用于导入。
- 选择一个自定义文件夹来保存数据文件,而不是主文件列表。导入数据文件后,可以随时将其移动到自定义文件夹。
- 通过输入新类别或点击类别字段显示现有类别标签,为数据文件分配类别标签。
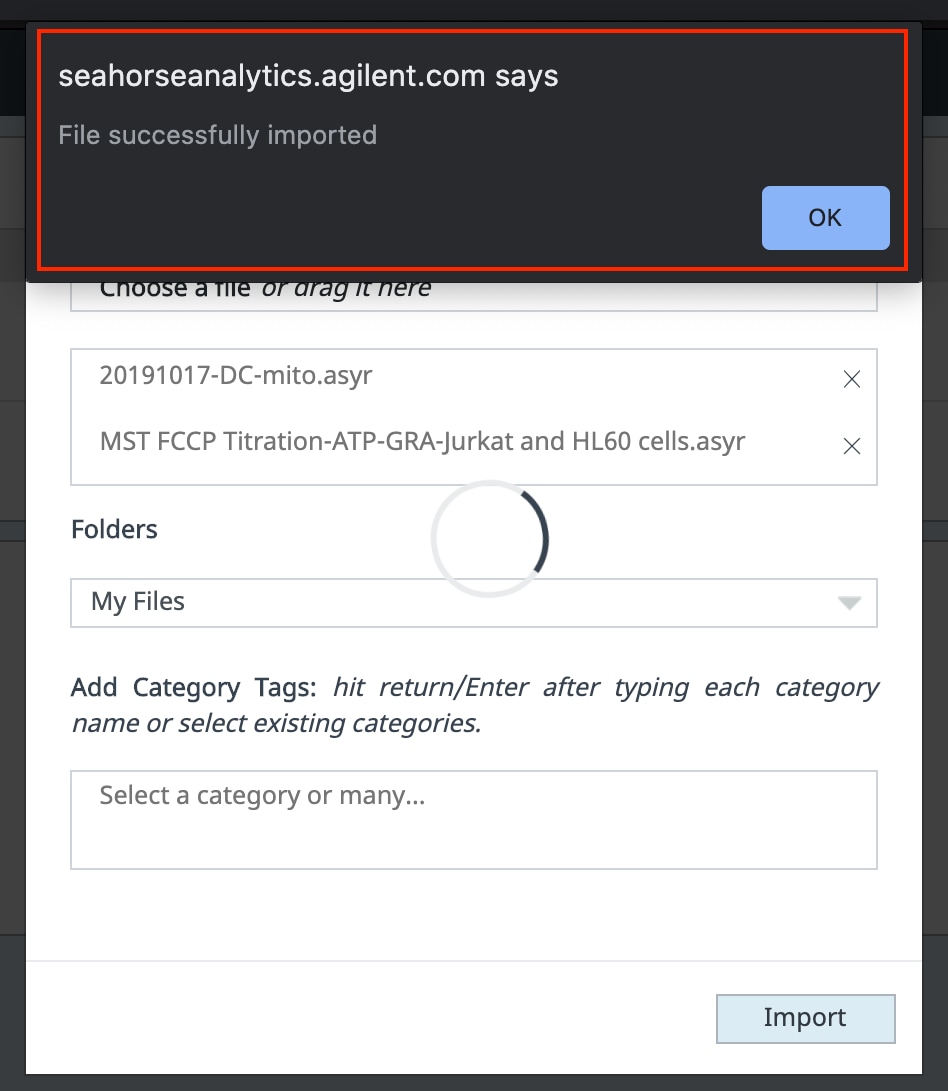
- 单击 Import(导入)
- Seahorse Analytics 将确认文件导入成功。关闭此对话框时,将看到导入的文件显示在文件列表第一位。
- 单击 Upload(上传)
- Seahorse Analytics 将确认文件导入成功。关闭此对话框时,将看到导入的文件显示在文件列表第一位。
其他文件管理功能:
在账户中每个文件的右侧,可以看到一个 3 点图标(如下图所示)。
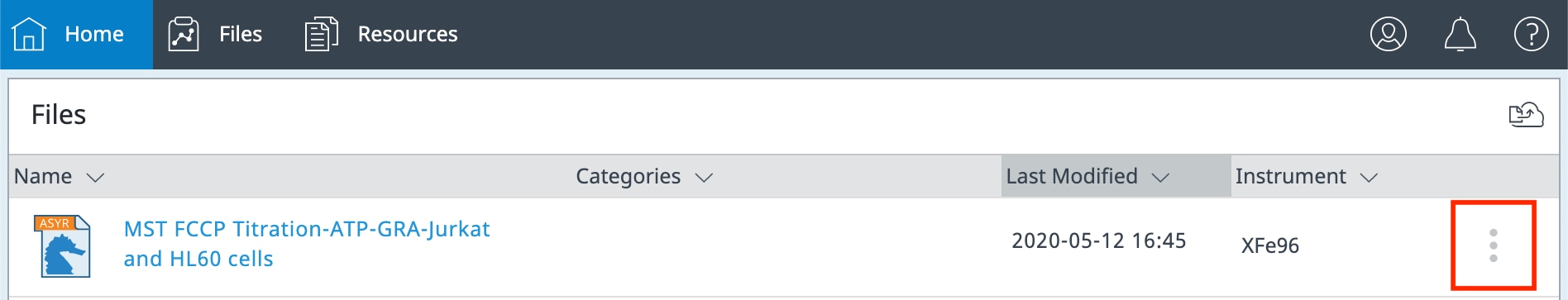
点击此 3 点按钮可显示更多文件功能,包括:
- Send To(发送至):显示共享对话框,输入要发送选定文件的电子邮件地址。
- Delete(删除):从账户中删除选定的文件。
- Categories(类别):添加或删除类别标签。
- Make a Copy(生成副本):创建所选文件的副本。
- Rename(重命名):重命名选定的文件。
- Move to folder(移动到文件夹):将所选文件移动到自定义文件夹。
- Export to Excel & GraphPad Prism(导出到 Excel 和 GraphPad Prism):将选定分析结果文件中的数据导出到 Microsoft Excel 或 GraphPad Prism 文件。
- Download(下载):将选定的文件下载到您的 PC 上。
5.2 分析视图
5.2 数据类型
Seahorse Analytics 分析视图在一个页面中集成了多个小组件(图)。有 3 种不同的分析视图 — 标准分析视图、自定义分析视图和检测试剂盒助手分析视图。
- 标准分析视图包含基本的小组件选项,例如动力学曲线图、散点图和条形图,这些小组件选项用于查看特定速率测量或一系列速率测量(即动力学图)的 OCR、ECAR、PER。
- 自定义分析视图列表显示了包含用户选择的预定义小组件的所有自定义分析视图。可将任何类型的小组件添加到自定义分析视图中。
- 检测试剂盒助手分析视图列表显示的各分析视图上的小组件代表选定的安捷伦 Seahorse XF 检测试剂盒的已定义参数。检测试剂盒助手分析视图可用于对使用各自支持的安捷伦 Seahorse XF 分析工作流程和方案生成的文件进行数据分析。
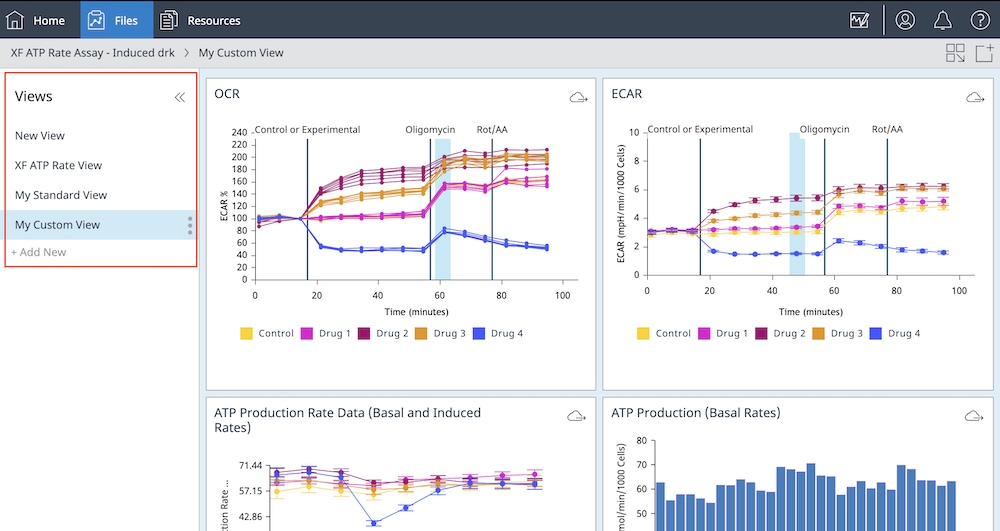
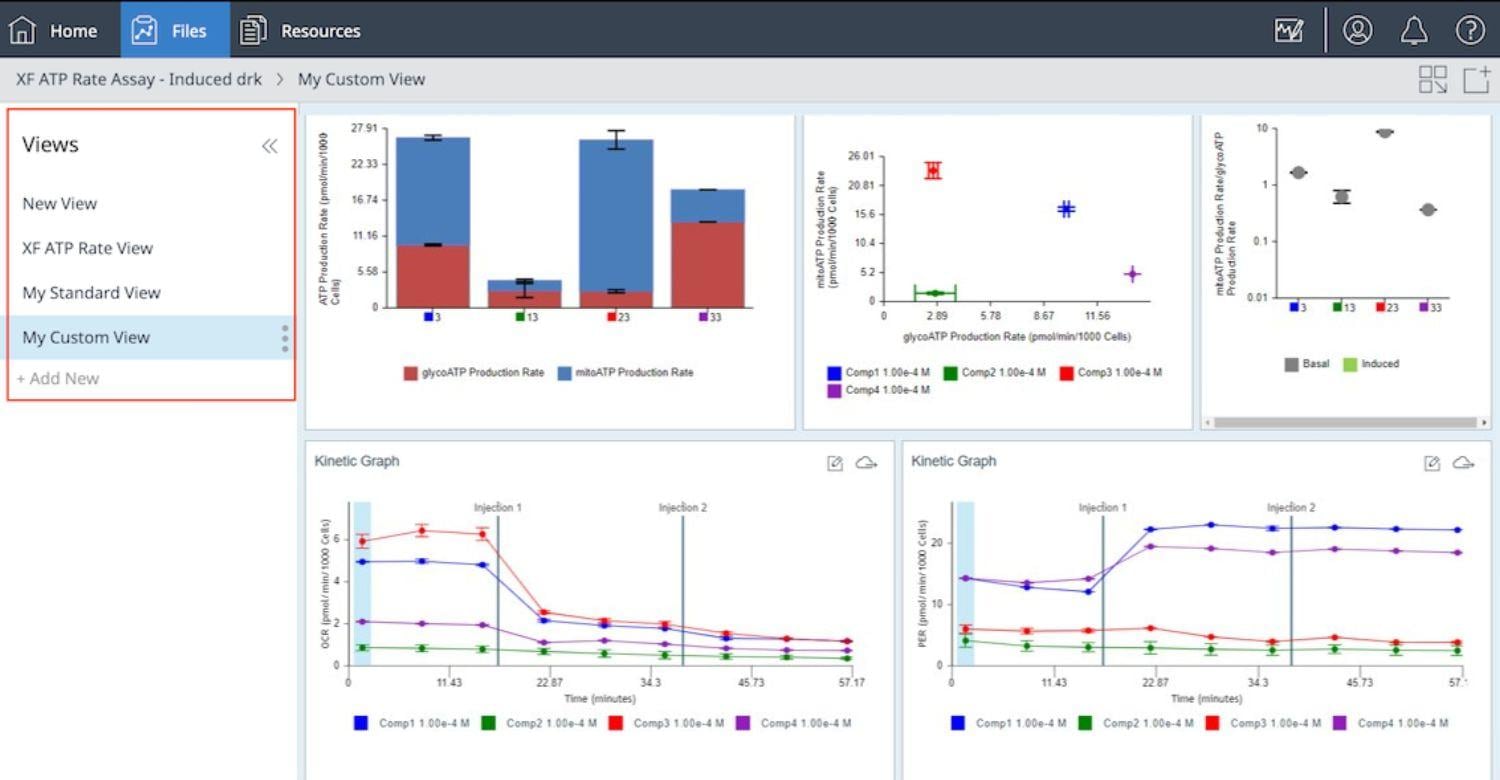
展开 Views(视图)列表以显示应用于分析结果文件的分析视图列表或添加新的分析视图(如下图所示)。
其他重要信息:
- 并非所有的 XF 分析工作流程都能使用 Seahorse Analytics 进行分析。您可以将结果数据导出至 Microsoft Excel 或 GraphPad Prism 以满足自定义分析需求。
- 每个小组件都有自己的板布局,用于控制该小组件的数据图。要编辑数据图,请双击小组件打开小组件编辑器视图。使用图形上方功能区中的功能以及图形右侧的板布局来控制数据图。如需执行文件级别的更改,请转到 Modify(修改)视图。
- 有时,您会希望对分析结果文件进行细微修改。可以通过点击功能区右上角的 Modify(修改)按钮从任何分析视图访问修改功能。使用修改功能对文件进行的更改将影响结果文件中的所有小组件/分析视图(即删除异常值孔、更改组颜色或重命名组)。
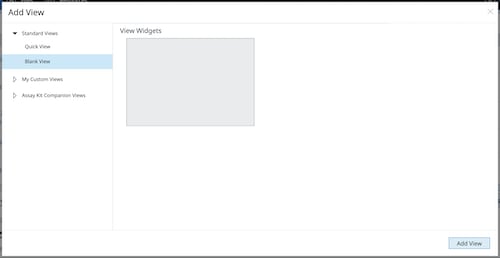
空白和自定义分析视图:自定义分析视图功能提供了出色的数据分析灵活性。您可以将任何分析视图保存为自定义视图,但本示例向您展示了如何从空白视图开始创建自定义分析视图。下面的一系列步骤还重点介绍了如何使用空白/自定义视图功能将分析工作流程中的常规步骤自动化,从而提高工作流程的一致性并节省时间。
a. 打开分析结果文件,选择 Standard Graphs > Blank View(标准图形 > 空白视图),然后点击 Add View(添加视图)
b. 点击 Add Widget(添加小组件),选择 Standard Graphs > Kinetic Graph(标准图形 > 动力学曲线),然后点击 Add Widget(添加小组件)
c. 在 Widget Editor(小组件编辑器)视图中,执行以下步骤:
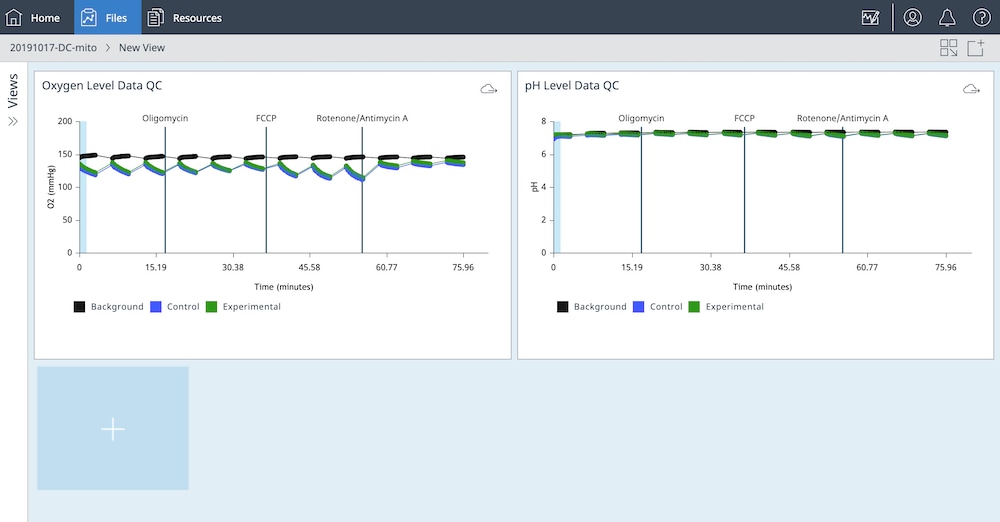
- 切换 Y1 > Level(Y1 > 水平)以显示 O2 水平数据
- 关闭 Background Correction(背景矫正)
- 双击小组件的名称并键入:Oxygen Level Data QC(氧气水平数据)
d. 点击返回箭头返回分析视图。
e. 点击 Add Widget(添加小组件)的“+”号(动力学曲线下方),选择 Standard Graphs > Kinetic Graph(标准图形 > 动力学曲线),然后点击 Add Widget(添加小组件)
f. 在 Widget Editor(小组件编辑器)视图中,执行以下步骤:
- 使用 Rate(速率)下拉菜单并选择 ECAR
- 切换 Y1 > Level(Y1 > 水平)以显示 pH 水平数据
- 关闭 Background Correction(背景矫正)
- 双击小组件的名称并键入:pH Level Data QC(pH 水平数据 QC)
g. 点击返回箭头以返回分析视图。
h. 展开分析视图右侧的 Views(视图)菜单,然后点击“New View”(新建视图)分析视图名称右侧的 3 个点。
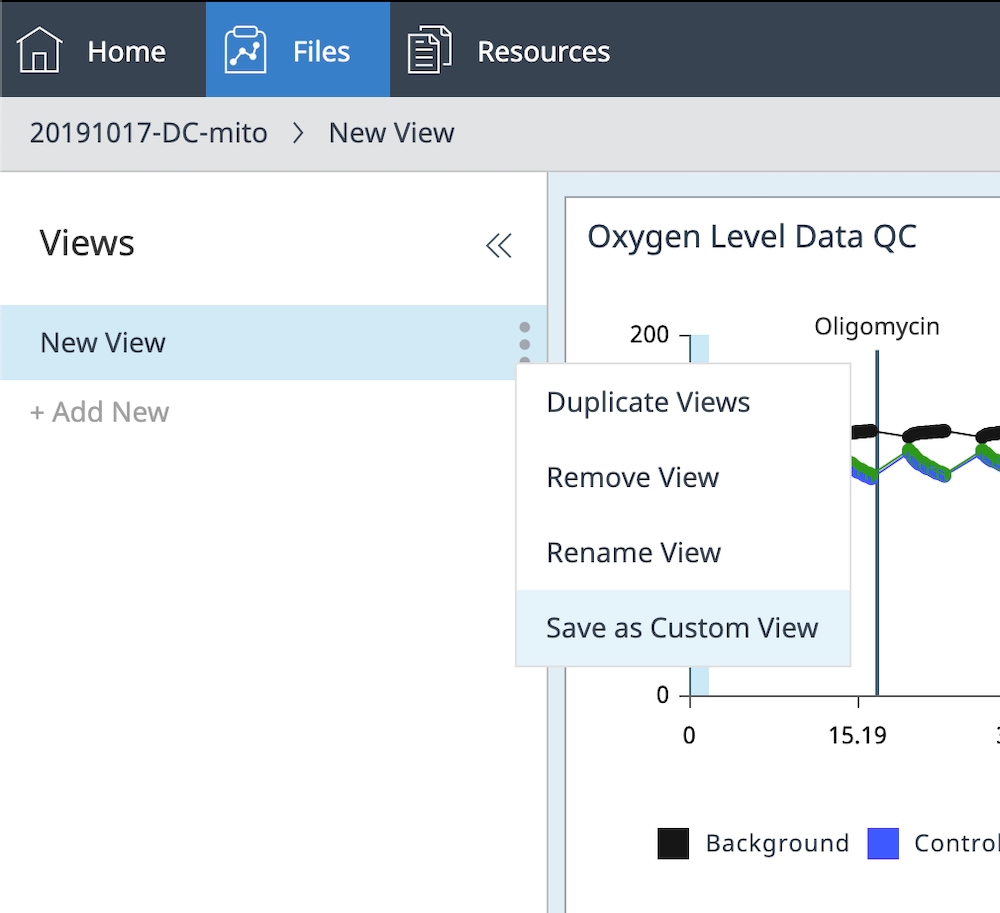
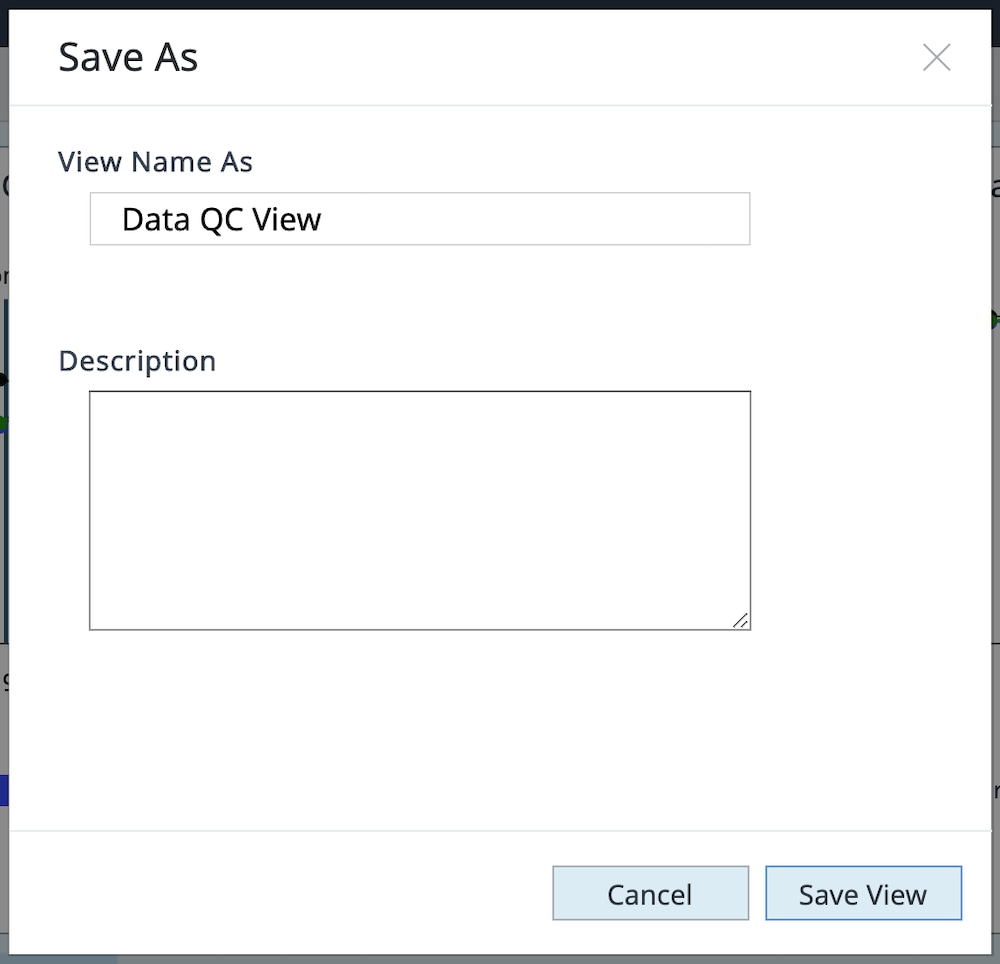
i. 点击 Save as Custom View(另存为自定义视图)并键入自定义视图名称(如数据 QC 视图)
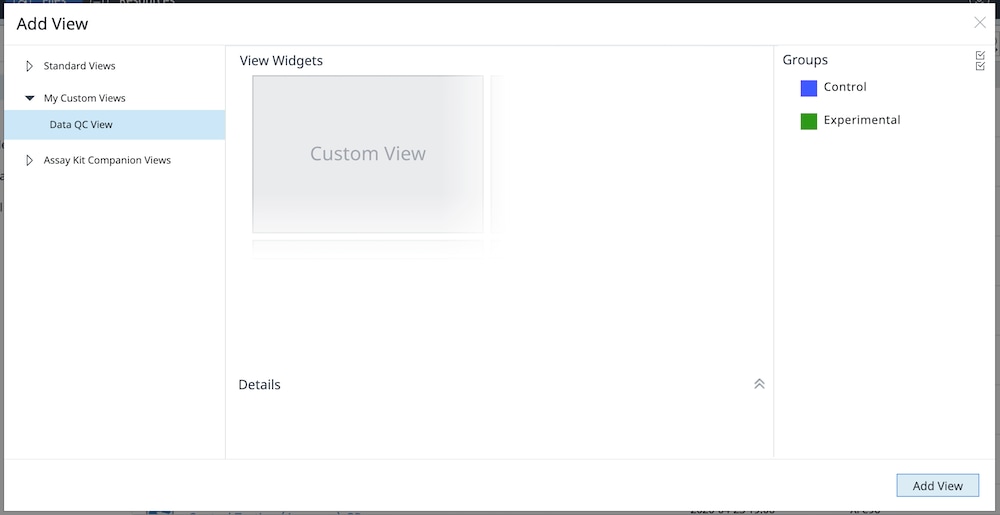
j. 下一次导入数据文件进行分析时,将可选择自定义的数据 QC 视图,从而节省为每个导入的新文件创建相同分析文件的时间。
检测试剂盒助手分析视图信息:
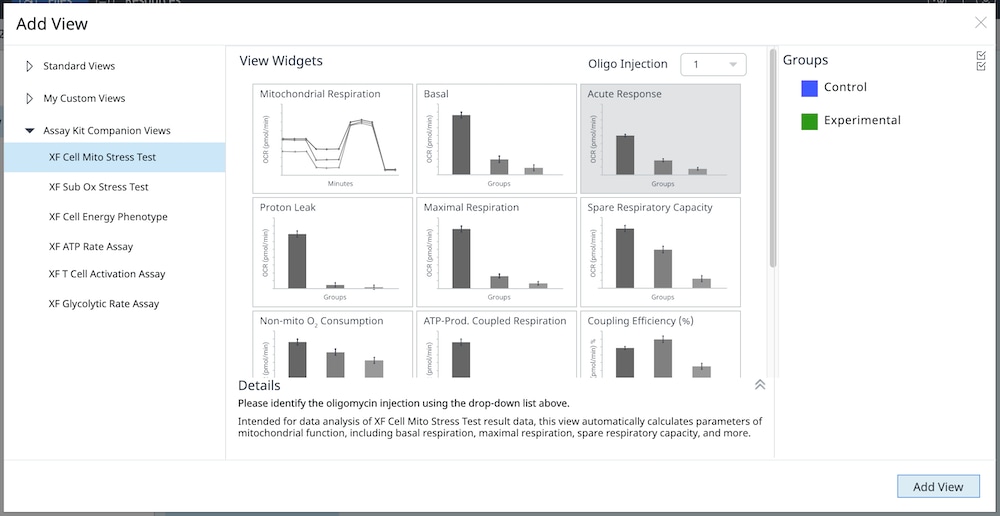
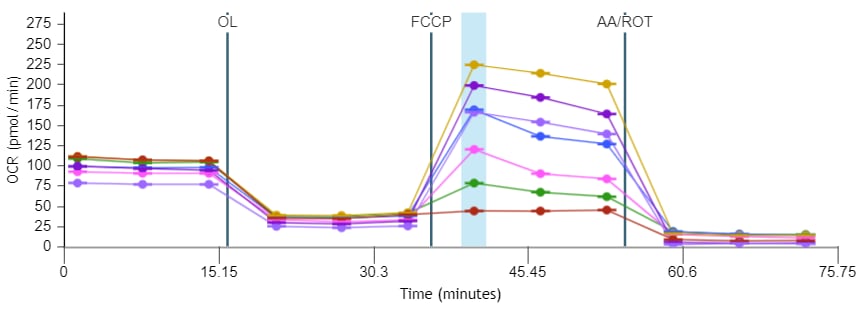
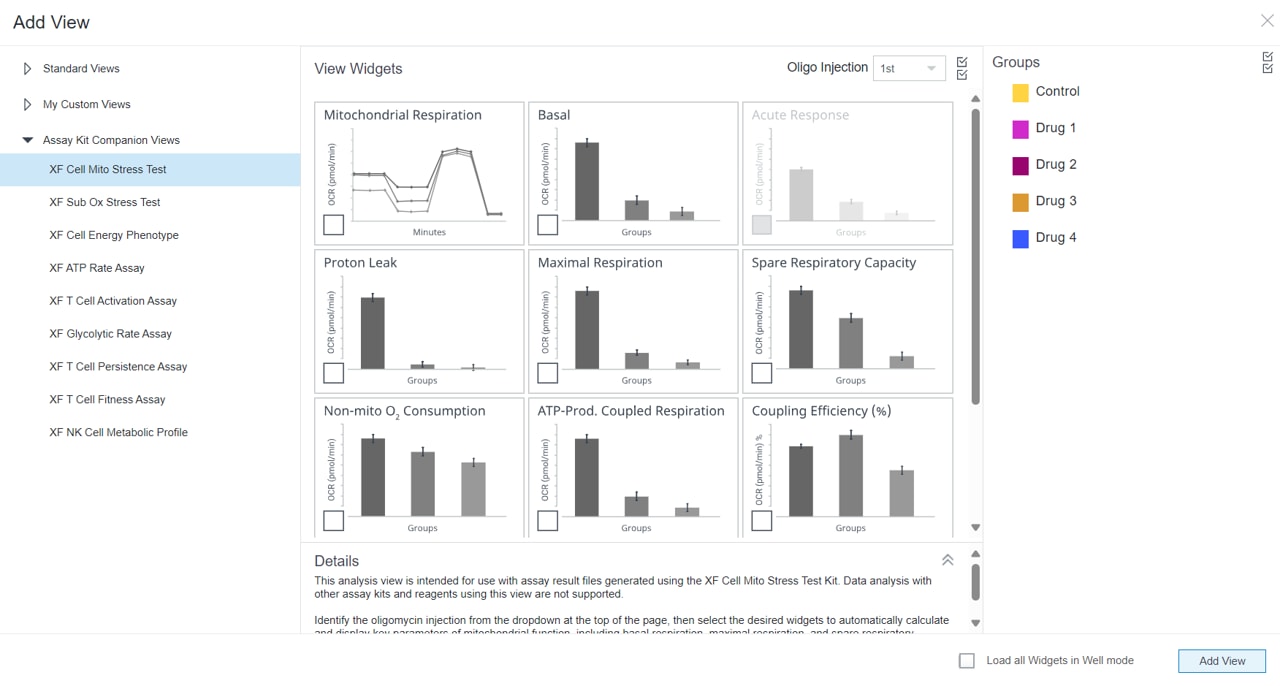
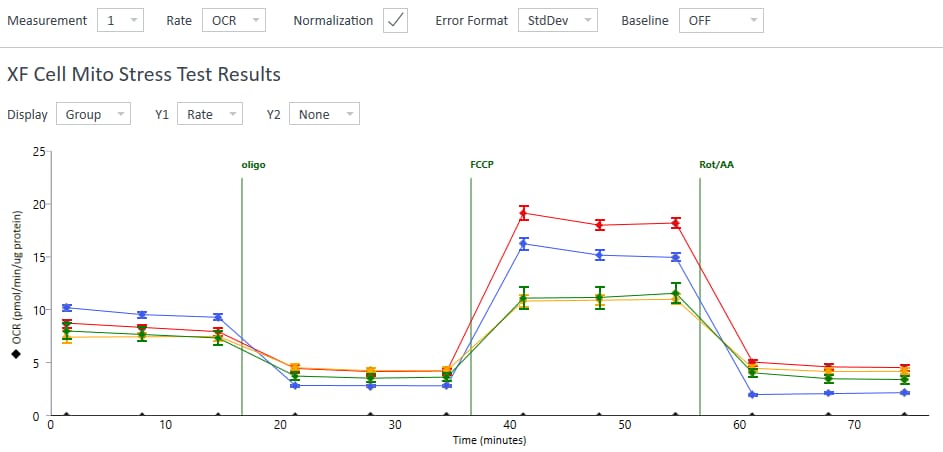
1. Assay Kit Companion Analysis View » XF Cell Mito Stress Test(检测试剂盒助手分析视图 » XF 细胞线粒体压力测试):要在单个分析视图中计算并显示 XF 细胞线粒体压力测试检测参数:
- 在 Add View(添加视图)窗口中,点击 Assay Kit Companion View(检测试剂盒助手视图)列表以展开选项列表。
- 点击 XF Cell Mito Stress Test(XF 细胞线粒体压力测试)分析视图以显示检测参数小组件。
- 重要提示:对于涉及 4 次加药的 XF 细胞线粒体压力测试,必须使用小组件上方的下拉菜单确定哪一次是寡霉素,然后才能添加此分析视图。这一步骤非常重要,因为正确选择了哪一次是寡霉素加药才能正确计算检测参数;寡霉素加药选择错误将导致小组件计算和图形不正确。
- 选择所需的参数小组件(例如基础呼吸、最大呼吸等)添加到分析视图。小组件周围的蓝色轮廓表示其已被选中。如果 Acute Response(急性响应)小组件呈灰色,则不能选择,因为该参数仅适用于急性加药的 XF 细胞线粒体压力测试分析。
- 如有必要,在组列表中关闭/打开组,然后点击 Add View(添加视图)
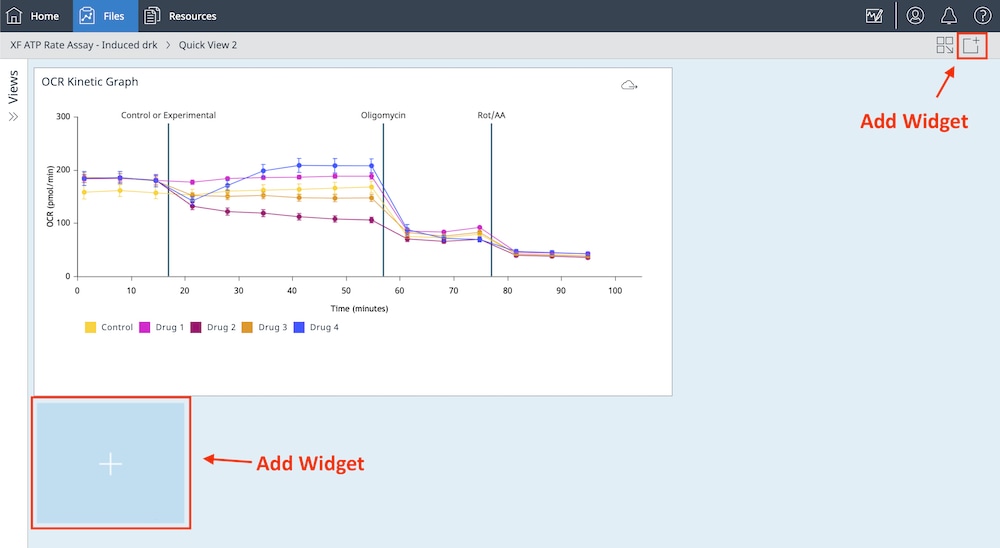
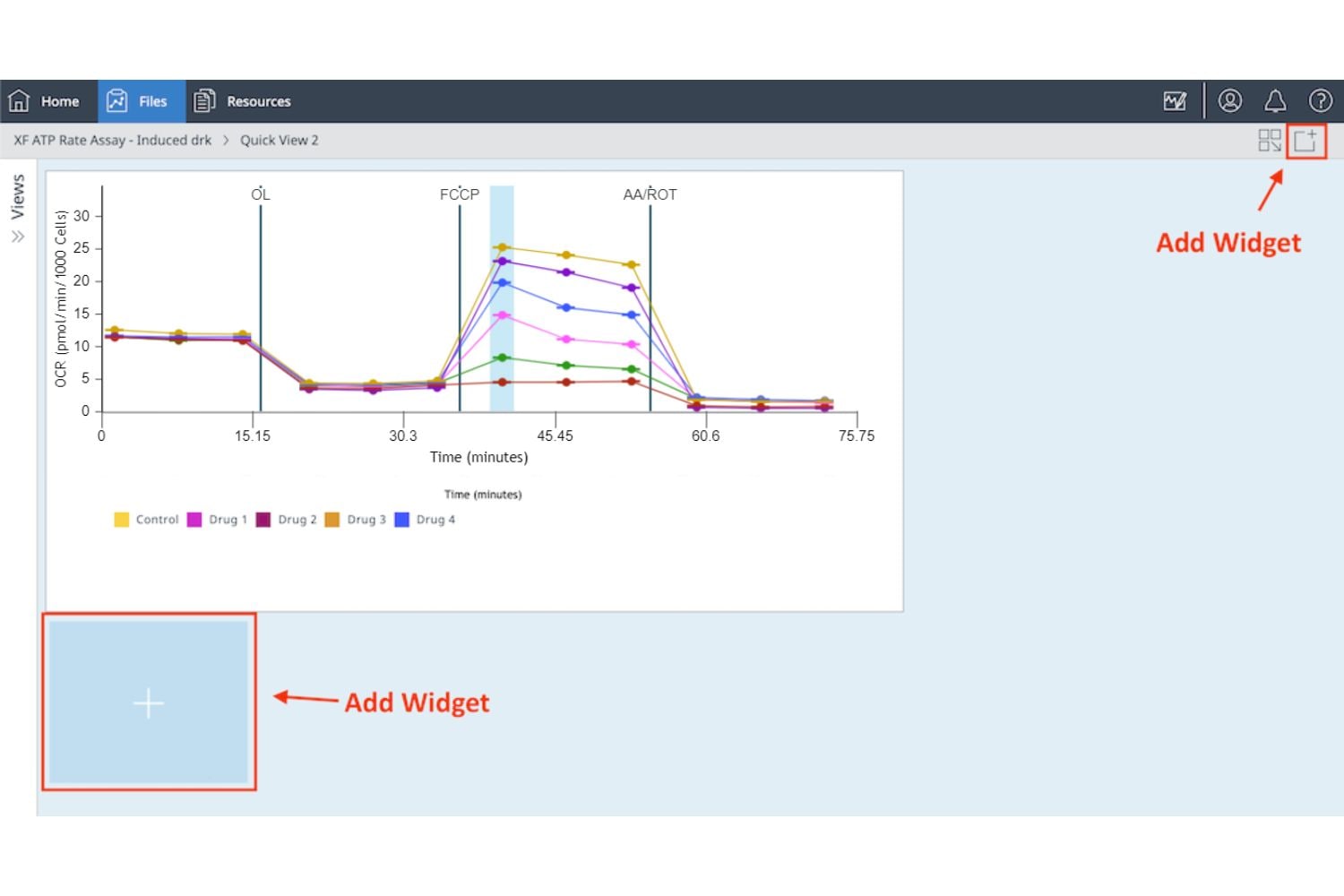
还可以将单个 XF 细胞线粒体压力测试检测参数小组件(即备用呼吸能力)添加到现有分析视图中:
a. 点击 Add Widget(添加小组件)按钮(如右图红色框所示)。
b. 展开 XF Cell Mito Stress Test(XF 细胞线粒体压力测试)小组件列表,选择所需的小组件,然后点击 Add Widget(添加小组件)。
重要提示:对于涉及 4 次加药的 XF 细胞线粒体压力测试,必须使用小组件上方的下拉菜单确定哪一次是寡霉素,然后才能将选定的小组件添加到分析视图。这一步骤非常重要,因为正确选择了哪一次是寡霉素加药才能正确计算检测参数;寡霉素加药选择错误将导致小组件计算和图形不正确。
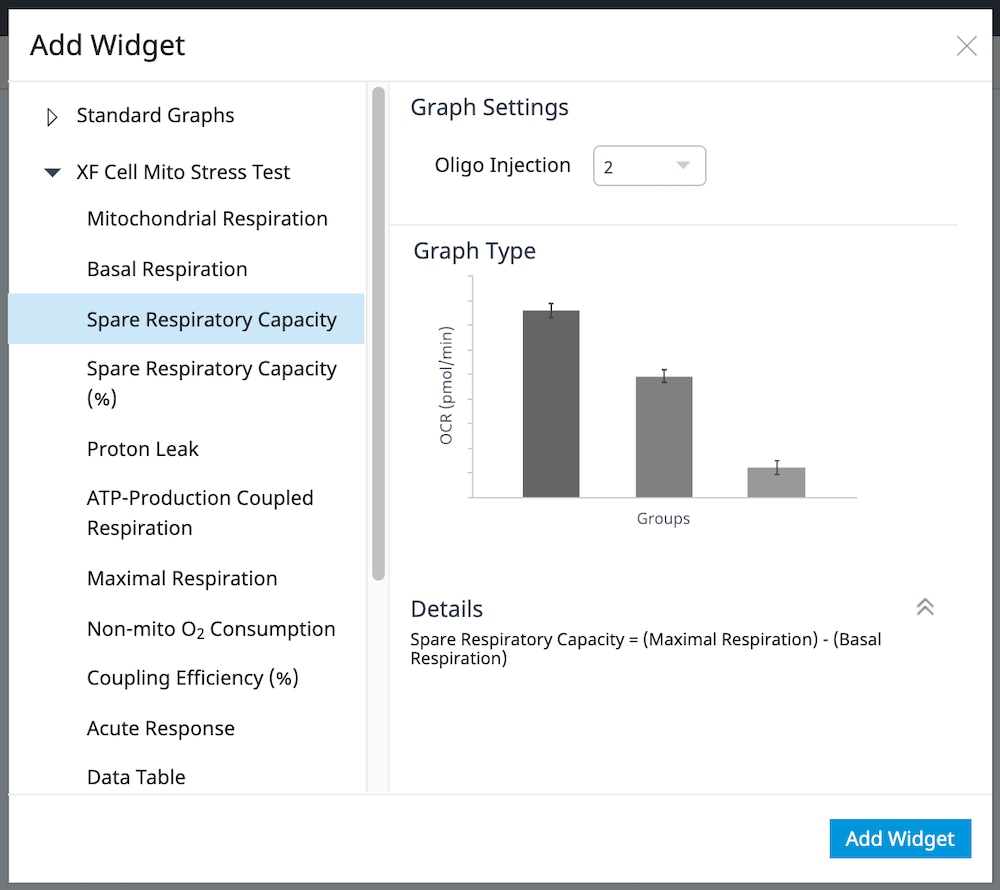
下表介绍了 XF 细胞线粒体压力测试检测参数的计算:
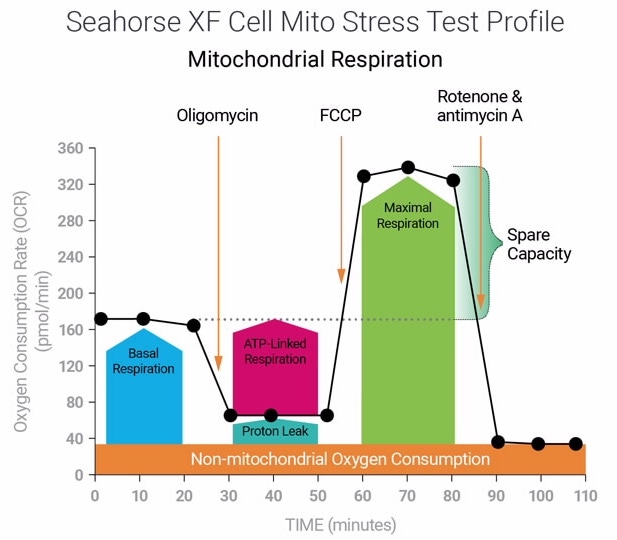
| 检测参数 | 公式 |
|---|---|
| 非线粒体耗氧量 | 加入鱼藤酮和抗霉素 A 后的最低速率测量值 |
| 基础呼吸 | (首次加药前的末次速率测量值)–(非线粒体耗氧量) |
| 最大呼吸 | (加入 FCCP 后的最大速率测量值)–(非线粒体耗氧量) |
| 质子漏 | (加入寡霉素后的最小速率测量值)–(非线粒体耗氧量) |
| ATP 生成关联呼吸 | (加入寡霉素前的末次速率测量值)–(加入寡霉素后的最小速率测量值) |
| 备用呼吸能力 | (最大呼吸)–(基础呼吸) |
| 备用呼吸能力 (%) | (最大呼吸)/(基础呼吸)× 100% |
| 急性响应 | (加入寡霉素前的末次速率测量值)–(急性加药前的末次速率测量值) |
| 关联效率 | (ATP 生成关联呼吸)/(基础呼吸)× 100% |
2. Assay Kit Companion Analysis View » XF Substrate Oxidation Stress Test(检测试剂盒助手分析视图 » XF 底物氧化压力测试):要在单个分析视图中计算并显示 XF 底物氧化压力测试检测参数:
- 在 Add View(添加视图)窗口中,点击 Assay Kit Companion View(检测试剂盒助手视图)列表以展开选项列表。
- 点击 XF Sub Ox Stress Test(XF 底物氧化压力测试)分析视图以显示检测参数小组件。
- 选择所需的参数小组件添加到分析视图。小组件周围的蓝色轮廓表示其已被选中。
- 可选:通过 FCCP Max Rate(FCCP 最大速率)下拉列表可选择加入 FCCP 后使用哪个测量点计算最大呼吸。使用默认选项,Seahorse Analytics 将计算每组的最大呼吸;最大响应可能因组而异(即,组 1 的最大响应是加入 FCCP 后的第一个测量值,组 2 的最大响应是加入 FCCP 后的第三个测量值)。
还可以选择特定的速率测量值来计算最大呼吸,Seahorse Analytics 将针对每组使用相同的加入 FCCP 后的速率测量值。使用上述示例,可以让 Seahorse Analytics 使用特定的加入 FCCP 后的速率测量值来计算所有组的最大响应,而不是计算组内最大呼吸。 - 如有必要,在组列表中关闭/打开组,然后点击 Add View(添加视图)

还可以将单个 XF 底物氧化压力测试检测参数小组件(即最大呼吸)添加到现有分析视图中:
a. 点击 Add Widget(添加小组件)按钮(如右图红色框所示)。

b. 展开 XF 底物氧化压力测试小组件列表,选择所需的小组件,然后点击 Add Widget(添加小组件)。
下表介绍了 XF 底物氧化压力测试检测参数的计算:
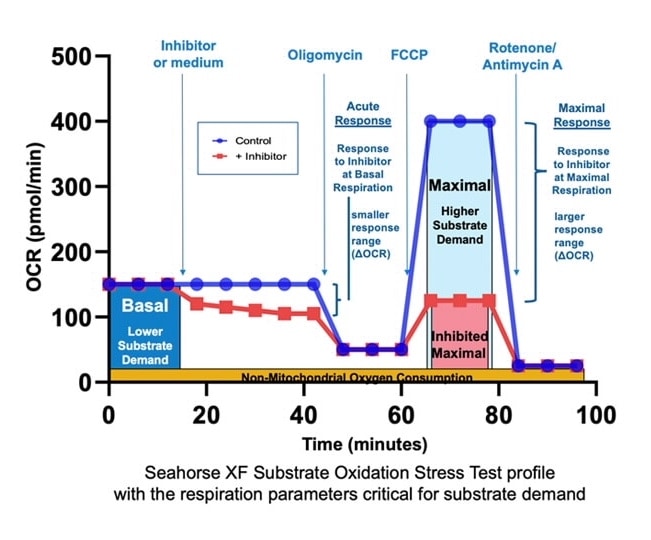
| 检测参数 | 公式 |
|---|---|
| 基础呼吸 | (首次加药前的末次速率测量值)–(非线粒体耗氧量*) |
| 最大呼吸 | (加入 FCCP 后的最大速率测量值)–(非线粒体耗氧量*) |
| 急性响应 | (加入寡霉素前的末次速率测量值)–(急性加药前的末次速率测量值) |
| * 非线粒体耗氧量 | 加入鱼藤酮和抗霉素 A 后的最低速率测量值 |
| 请注意:底物氧化压力测试检测方案与采用急性加药的 XF 细胞线粒体压力测试的检测方案相同,因此可以通过从 Add Widget > XF Cell Mito Stress Test(添加小组件 > XF 细胞线粒体压力测试)小组件列表中选择所需的检测参数,从 XF 底物氧化压力测试数据文件中获得其他 XF 细胞线粒体压力测试检测参数(例如质子漏、ATP 相关的 OCR、备用呼吸能力和非线粒体 OCR 等)。 | |
3. Assay Kit Companion Analysis View » XF Cell Energy Phenotype Test(检测试剂盒助手分析视图 » XF 细胞能量代谢表型测试):要在单个分析视图中计算并显示 XF 细胞能量代谢表型测试检测参数:
- 在 Add View(添加视图)窗口中,点击 Assay Kit Companion View(检测试剂盒助手视图)列表以展开选项列表。
- 点击 XF Cell Energy Phenotype(XF 细胞能量代谢表型测试)分析视图以显示检测参数小组件。
- 选择所需的参数小组件添加到分析视图。小组件周围的蓝色轮廓表示其已被选中。
- 如有必要,在组列表中关闭/打开组,然后点击 Add View(添加视图)
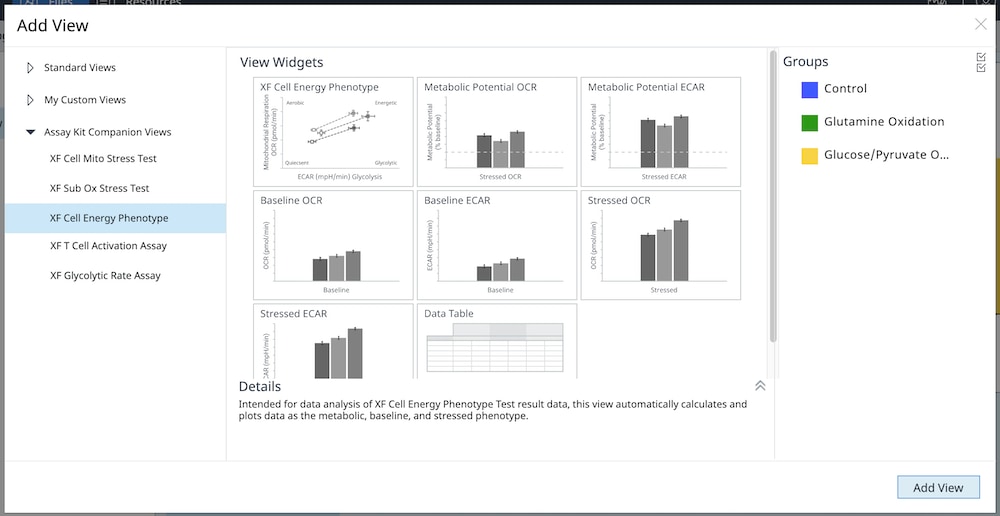
您还可以将单个 XF 细胞能量代谢表型测试检测参数小组件(即代谢潜能)添加到现有分析视图中:
a. 点击 Add Widget(添加小组件)按钮(如右图红色框所示)。

b. 展开 XF Cell Energy Phenotype Test(XF 细胞能量代谢表型测试),选择所需的小组件,然后点击 Add Widget(添加小组件)。

下表介绍了 XF 细胞能量代谢表型测试检测参数的计算:
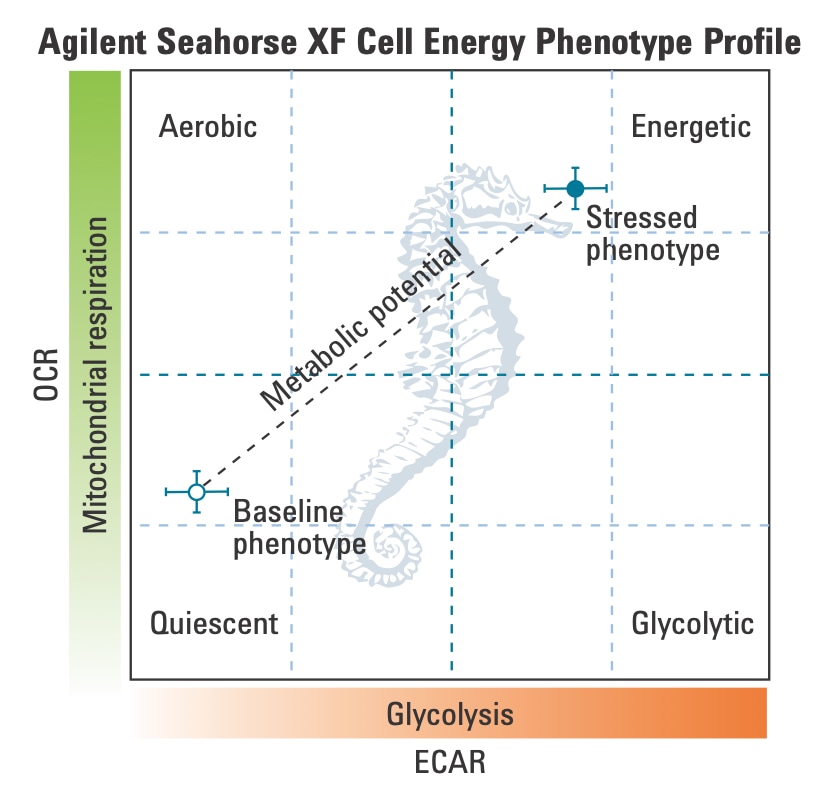
| 检测参数 | 公式 |
|---|---|
| 基线 OCR | 首次加药前的末次 OCR 速率测量值 |
| 基线 ECAR | 首次加药前的末次 ECAR 速率测量值 |
| 应激 OCR | 首次加药后的最大 OCR 速率测量值 |
| 应激 ECAR | 首次加药后的最大 ECAR 测量值 |
| 代谢潜能 (OCR) | (应激 OCR/基线 OCR)× 100% |
| 代谢潜能 (ECAR) | (应激 ECAR/基线 ECAR)× 100% |
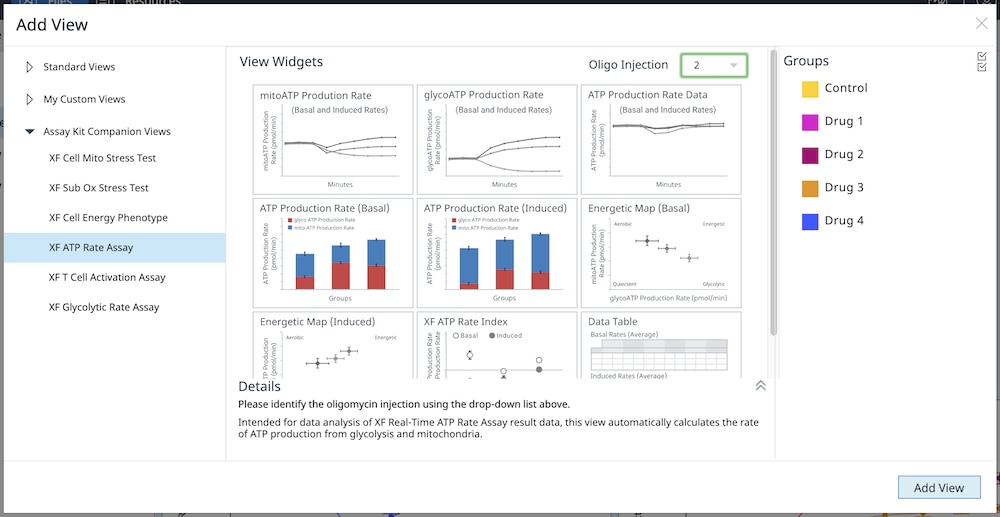
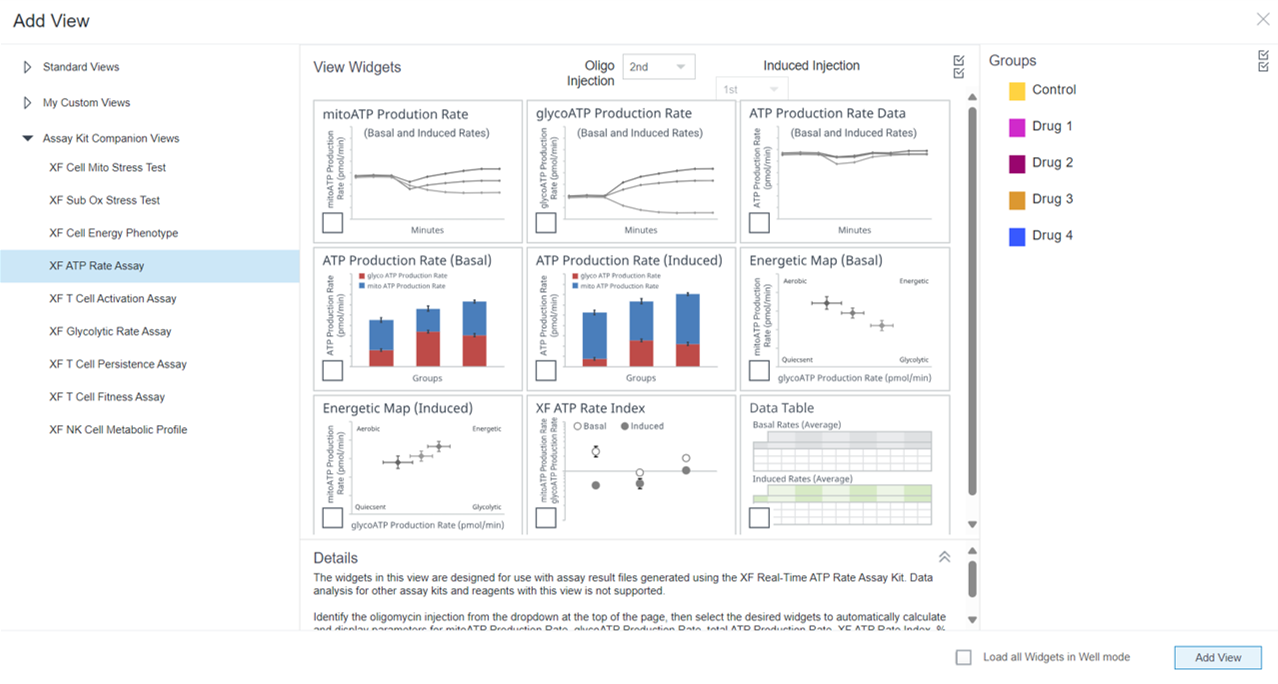
4.2. Assay Kit Companion Analysis View » XF Real-Time ATP Rate Assay(检测试剂盒助手分析视图 » XF 实时 ATP 速率测定):按照下面的步骤在单个分析视图中计算并显示 XF 实时 ATP 速率测定参数。请注意,必须正确配置缓冲系数,才能将此分析视图和此分析视图的小组件添加到分析结果文件中。
- 在 Add View(添加视图)窗口中,点击 Assay Kit Companion View(检测试剂盒助手视图)列表以展开选项列表。
- 点击 XF ATP Rate Assay(XF ATP 速率测定)分析视图以显示检测参数小组件。
- 对于诱导 XF ATP 速率测定(寡霉素和鱼藤酮/抗霉素 A 标准加药前进行 1 或 2 次加药),必须使用小组件上方的下拉菜单确定寡霉素加药是第 2 次还是第 3 次,然后才能添加此分析视图。这一步非常重要,只有正确选择了哪一次是寡霉素加药才能正确计算检测参数;寡霉素加药选择错误将导致小组件计算和图形不正确。有关这两个工作流程的更多信息,请参阅 XF 实时 ATP 速率测定用户手册。
- 选择所需的参数小组件添加到分析视图。小组件周围的蓝色轮廓表示其已被选中。如果小组件呈灰色,则不能选择,因为分析文件不满足计算参数所需的最少加药次数要求。
- 如有必要,在组列表中关闭/打开组,然后点击 Add View(添加视图)
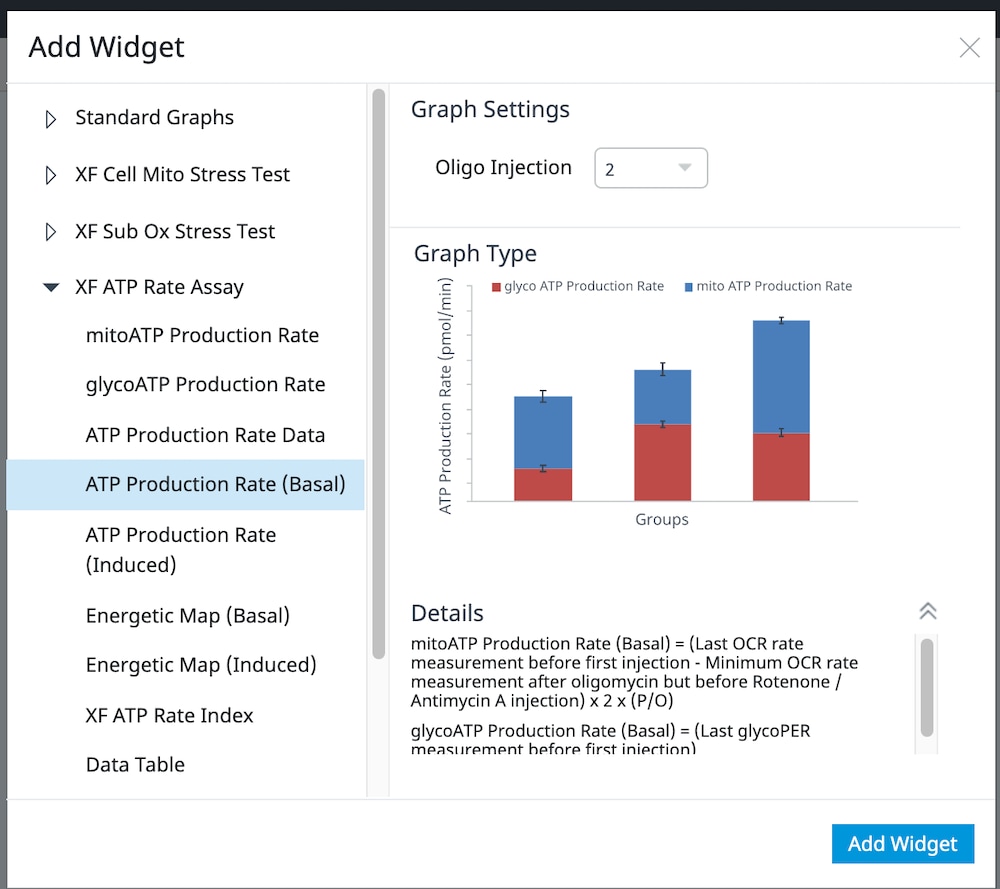
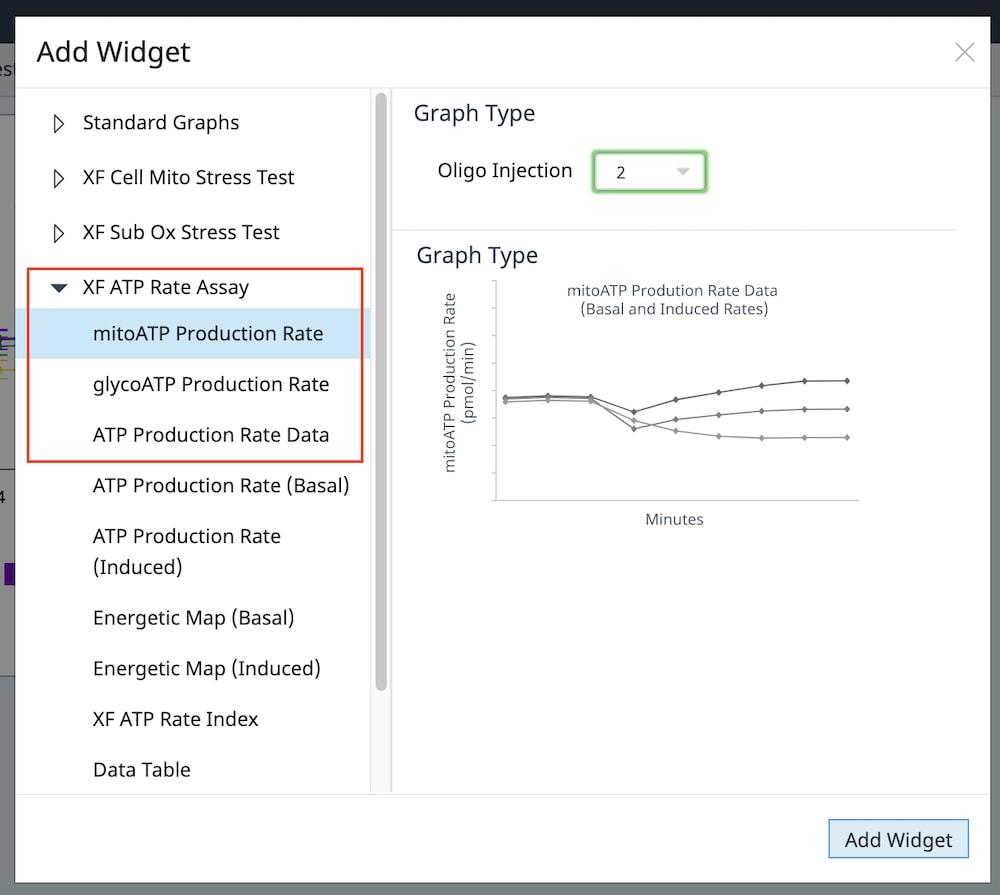
还可以将单个 XF ATP 速率测定参数小组件(即 ATP 产生速率(基础))添加到现有分析视图中:
a. 点击 Add Widget(添加小组件)按钮(如右图红色框所示)。

b. 展开 XF ATP 速率测定小组件列表,选择所需的小组件,然后点击 Add Widget(添加小组件)。
重要提示:对于诱导 XF ATP 速率测定(寡霉素和鱼藤酮/抗霉素 A 标准加药前进行 1 或 2 次加药),必须使用小组件上方的下拉菜单确定寡霉素加药是第 2 次还是第 3 次,然后才能添加此分析视图。这一步非常重要,只有正确选择了哪一次是寡霉素加药才能正确计算检测参数;寡霉素加药选择错误将导致小组件计算和图形不正确。
下表介绍了标准和诱导检测工作流程的 XF 实时 ATP 速率测定参数计算:
标准 XF 实时 ATP 速率测定
| 检测参数 | 公式 |
|---|---|
| 线粒体呼吸 ATP 产生速率(基础) | [(首次加药前末次 OCR 速率测量值 - 加入寡霉素后至加入 Rot/AA 前最小 OCR 速率测量值)× 2 × (P/O)] |
| 糖酵解 ATP 产生速率(基础) | 首次加药前末次 glycoPER 测量值 |
| 总 ATP 产生速率(基础) | (线粒体呼吸 ATP 产生速率)+(糖酵解 ATP 产生速率) |
| XF ATP 速率指数(基础) | (线粒体呼吸 ATP 产生速率)/(糖酵解 ATP 产生速率) |
诱导 XF 实时 ATP 速率测定:
| 检测参数 | 公式 |
|---|---|
| 线粒体呼吸 ATP 产生速率(基础) | [(首次加药前末次 OCR 速率测量值 - 加入寡霉素后至加入 Rot/AA 前最小 OCR 速率测量值)× 2 × (P/O)] |
| 糖酵解 ATP 产生速率(基础) | 首次加药前末次 glycoPER 测量值 |
| 总 ATP 产生速率(基础) | (线粒体呼吸 ATP 产生速率)+(糖酵解 ATP 产生速率) |
| XF ATP 速率指数(基础) | (线粒体呼吸 ATP 产生速率)/(糖酵解 ATP 产生速率) |
| 线粒体呼吸 ATP 产生速率(诱导) | (急性加药后和加入寡霉素前的平均 OCR 速率测量值)-(加入寡霉素后和加入 Rot/AA 前的最小 OCR 速率测量值)]× 2 × (P/O) |
| 糖酵解 ATP 产生速率(诱导) | 急性加药后和下一次加药前的糖酵解 ATP 产生速率测量值的平均值。 |
| 总 ATP 产生速率(诱导) | 线粒体呼吸 ATP 产生速率(诱导)+ 糖酵解 ATP 产生速率(诱导) |
| XF ATP 速率指数(诱导) | 线粒体呼吸 ATP 产生速率(诱导)/糖酵解 ATP 产生速率(诱导) |
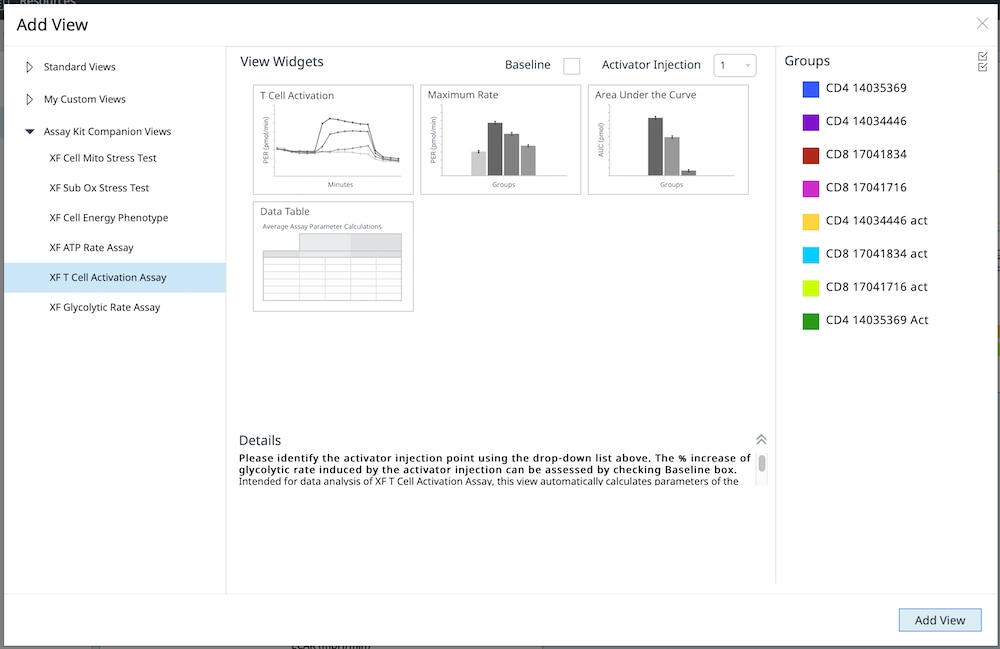
5.3. Assay Kit Companion Analysis View » XF T Cell Activation Assay(检测试剂盒助手分析视图 » XF T 细胞活化测定):要在单个分析视图中计算并显示 XF T 细胞活化测定参数:
- 在 Add View(添加视图)窗口中,点击 Assay Kit Companion View(检测试剂盒助手视图)列表以展开选项列表。
- 点击 XF T Cell Activation Assay(XF T 细胞活化测定)分析视图以显示检测参数小组件。
- 选中 Baseline(基线)复选框以计算每个小组件中显示的 PER 数据,以相对于基线速率测量值的百分比 (%) 表示,基线速率测量值是加入活化剂前的最后一次速率测量值。对于定量数据,请勿选中 Baseline(基线)复选框,以 pmol/min 为单位计算 PER。
- 确保在 Activator Injection(加入活化剂)下拉菜单中选择了正确的加药位置。
- 选择所需的参数小组件添加到分析视图。小组件周围的蓝色轮廓表示其已被选中。
- 如有必要,在组列表中关闭/打开组,然后点击 Add View(添加视图)
您还可以将单个 XF T 细胞活化测定参数小组件(即最大速率)添加到现有分析视图中:
c. 点击 Add Widget(添加小组件)按钮(如右图红色框所示)。

d. 展开 XF T Cell Activation Assay(XF T 细胞活化测定),选择所需的小组件,然后点击 Add Widget(添加小组件)。
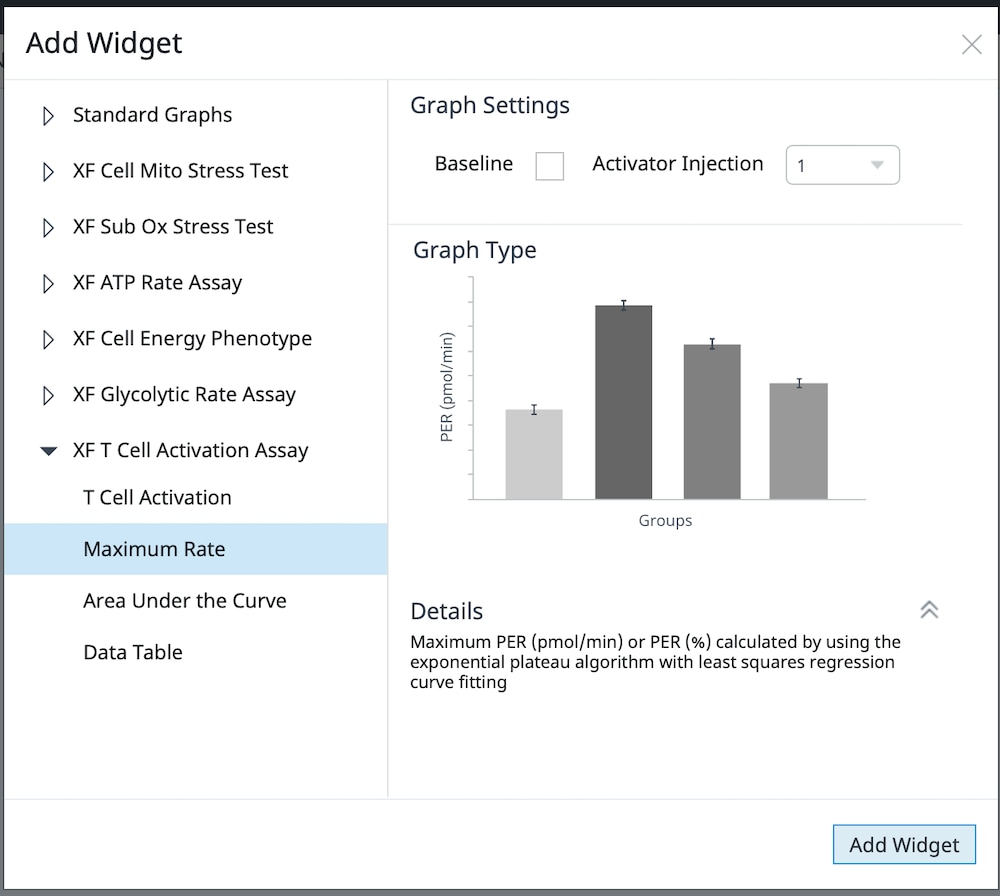
下表介绍了 XF T 细胞活化测定参数的计算:
| 检测参数 | 公式 |
|---|---|
| T 细胞活化 | PER(质子释放率)数据以动力学曲线显示 |
| 最大速率 | 在 Seahorse Analytics 中使用非线性最小二乘曲线拟合算法,使用加入活化剂后和加入 2-DG 前的速率测量数据进行计算。有关该计算方法的更多信息,请参阅: H. J. Motulsky, "Exponential plateau", GraphPad Curve Fitting Guide. Accessed 20 May 2020. https://www.graphpad.com/guides/prism/8/curve-fitting/REG_Exponential-plateau.htm 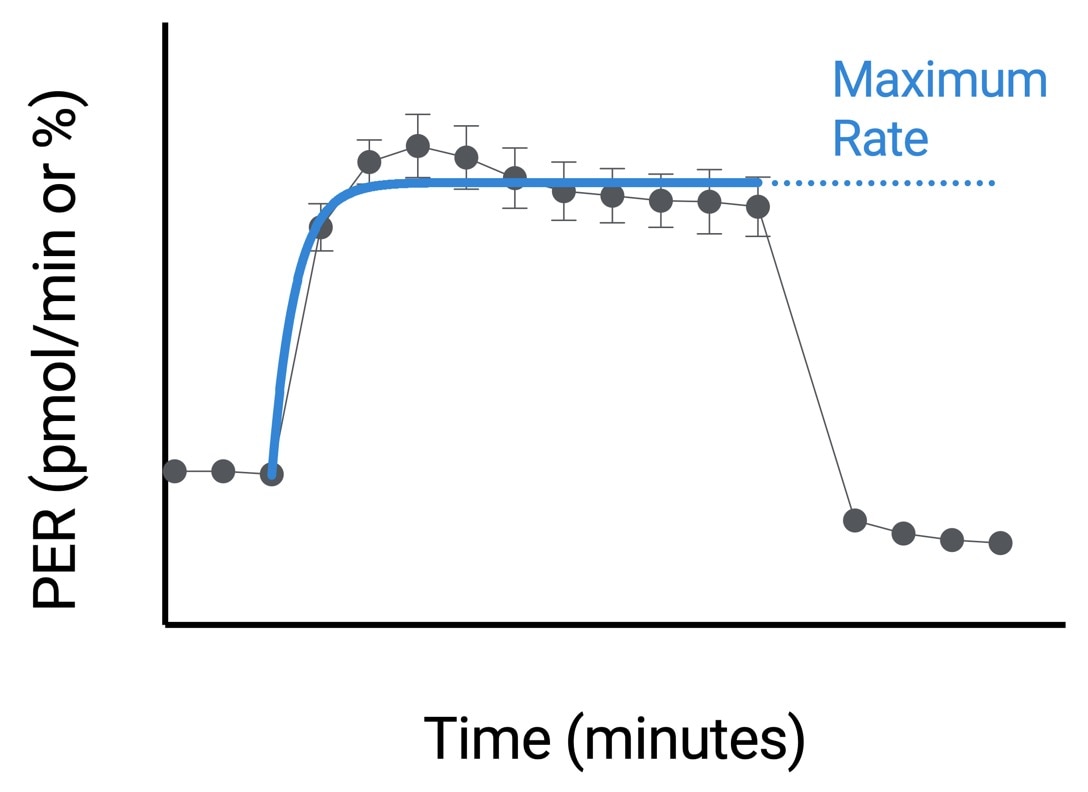 |
| 曲线下面积 | 在 Seahorse Analytics 中使用加入活化剂后和加入 2-DG 前的速率测量数据进行计算。AUC 值仅包括高于基线的峰值。有关该计算方法的更多信息,请参阅: H. J. Motulsky, "How to: Area under the curve", GraphPad Statistics Guide. Accessed 20 May 2020. https://www.graphpad.com/guides/prism/8/statistics/stat_area_under_the_curve.htm 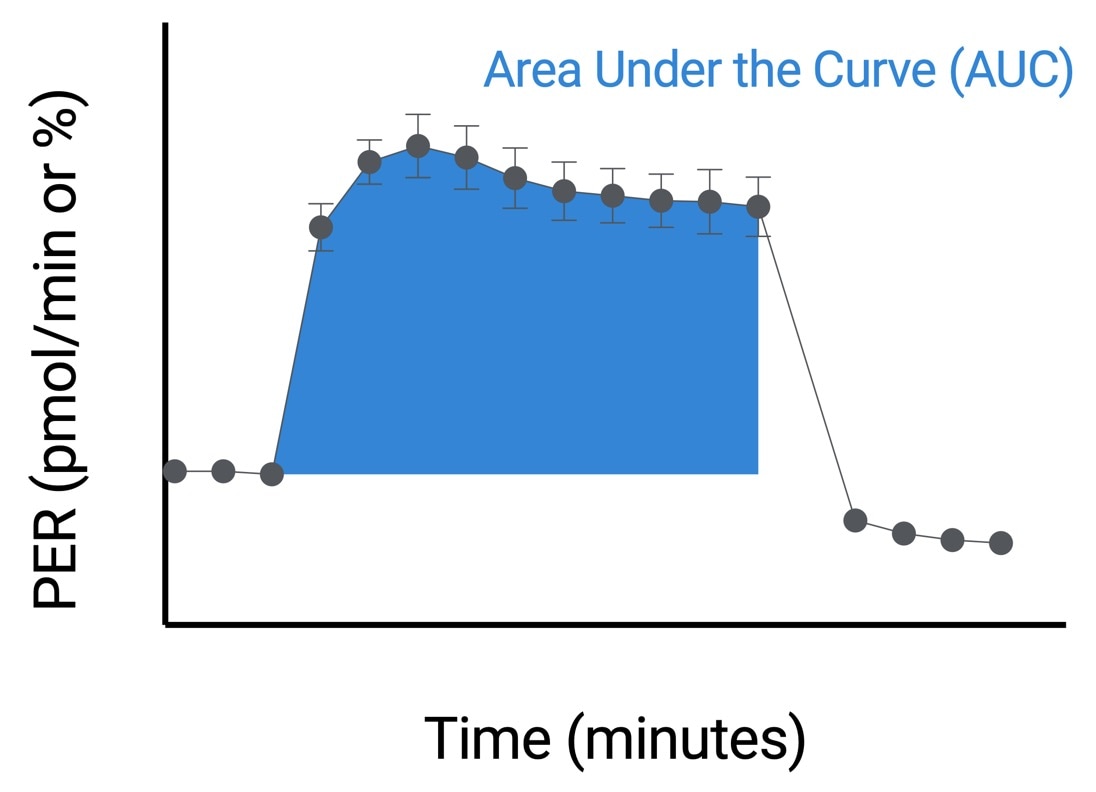 |
6.4. Assay Kit Companion Analysis View » XF Glycolytic Rate Assay(检测试剂盒助手分析视图 » XF 糖酵解速率测定):按以下步骤在单个分析视图中计算并显示 XF 糖酵解速率测定参数。请注意,必须正确配置缓冲系数,才能将此分析视图和此分析视图的小组件添加到分析结果文件中。
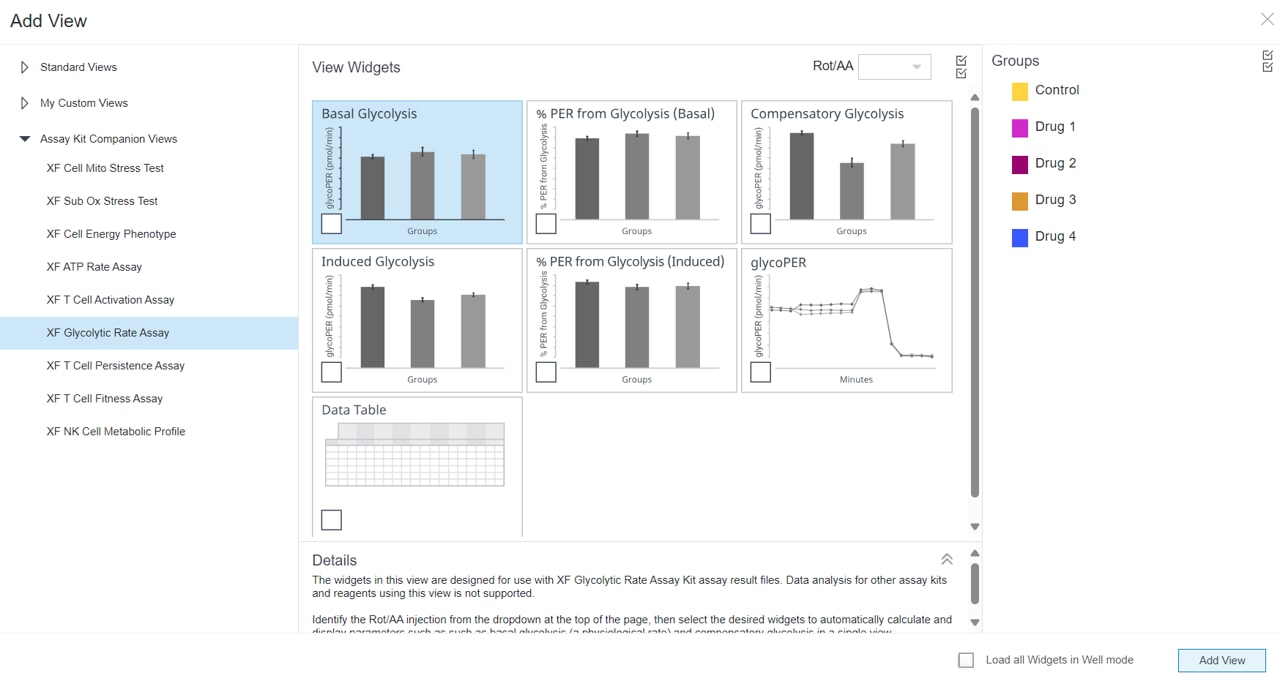
- 在 Add View(添加视图)窗口中,点击 Assay Kit Companion View(检测试剂盒助手视图)列表以展开选项列表。
- 点击 XF Glycolytic Rate Assay(XF 糖酵解速率测定)分析视图以显示检测参数小组件。
- 对于诱导 XF 糖酵解速率测定(鱼藤酮/抗霉素 A 和 2-DG 标准加药之前进行 1 或 2 次加药),必须使用小组件上方的下拉菜单确定哪一次是鱼藤酮/抗霉素-A 加药,然后才能添加此分析视图。这一步非常重要,只有正确选择了哪一次是鱼藤酮/抗霉素-A 加药才能正确计算检测参数;鱼藤酮/抗霉素-A 加药选择错误将导致小组件计算和图形不正确。有关这两个工作流程的更多信息,请参阅 XF 糖酵解速率测定用户手册。
- 选择所需的参数小组件添加到分析视图。小组件周围的蓝色轮廓表示其已被选中。如果小组件呈灰色,则不能选择,因为分析文件不满足计算参数所需的最少加药次数要求。
- 如有必要,在组列表中关闭/打开组,然后点击 Add View(添加视图)
您还可以将单个 XF 糖酵解速率测定参数小组件(即基础糖酵解)添加到现有分析视图中:
a. 点击 Add Widget(添加小组件)按钮(如右图红色框所示)。

b. 展开 XF 糖酵解速率测定小组件列表,选择所需的小组件,然后点击 Add Widget(添加小组件)。
重要提示:对于诱导 XF 糖酵解速率测定(鱼藤酮/抗霉素 A 和 2-DG 标准加药之前进行 1 或 2 次加药),必须使用小组件上方的下拉菜单确定哪一次是鱼藤酮/抗霉素-A 加药,然后才能添加此分析视图。这一步非常重要,只有正确选择了哪一次是鱼藤酮/抗霉素-A 加药才能正确计算检测参数;鱼藤酮/抗霉素-A 加药选择错误将导致小组件计算和图形不正确。
下表介绍了标准和诱导检测工作流程的 XF 糖酵解速率测定参数的计算:
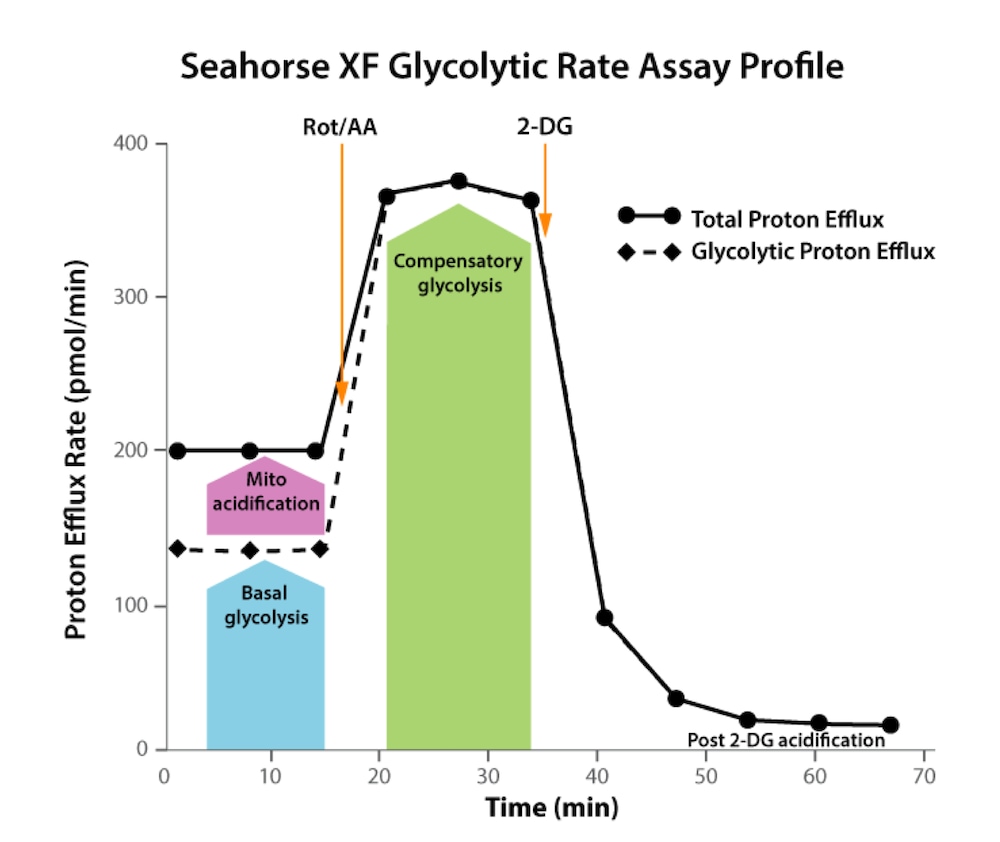
标准 XF 糖酵解速率测定
| 检测参数 | 公式 |
|---|---|
| 基础糖酵解 | 首次加药前末次 glycoPER 测量值 |
| 基础质子释放率 (PER)* | 首次加药前末次 PER 测量值 |
| 糖酵解 PER%(基础) | (基础糖酵解)/(基础 PER)× 100% |
| * 表示该参数未在 Seahorse Analytics 中单独报告,但用于计算其他报告的参数值。 | |
诱导 XF 糖酵解速率测定
| 检测参数 | 公式 |
|---|---|
| 基础糖酵解 | 首次加药前末次 glycoPER 测量值 |
| 基础质子释放率 (PER)* | 首次加药前末次 PER 测量值 |
| 糖酵解 PER%(基础) | (基础糖酵解)/(基础 PER)× 100% |
| 代偿糖酵解 | 加入 Rot/AA 后的最大 glycoPER 测量值 |
| 诱导糖酵解 | 诱导检测加药后和加入 Rot/AA 前的 glycoPER 测量值的平均值 |
| 诱导 PER* | 诱导检测加药后和下一次加药前的 PER 测量值的平均值 |
| 糖酵解 PER%(诱导) | (诱导糖酵解)/(诱导 PER)× 100% |
| * 表示该参数未在 Seahorse Analytics 中单独报告,但用于计算其他报告的参数值。 | |
编辑小组件数据图:要自定义小组件的数据图,请双击小组件打开小组件编辑器视图。有多种方式可为特定小组件自定义数据图。需要记住,每个小组件的板布局是独立的,意味着在小组件编辑视图上所做的更改将仅应用于相应的小组件。
每张图上方功能区中的功能提供针对该小组件类型的编辑功能,例如更改速率数据类型、打开/关闭归一化或逐孔查看数据而不是查看组平均值。有关这些功能及其使用方法的更多信息,请参阅关于不同小组件的说明。

图右侧的板布局允许您针对所选小组件,在计算和数据图中包括或排除特定的实验孔。
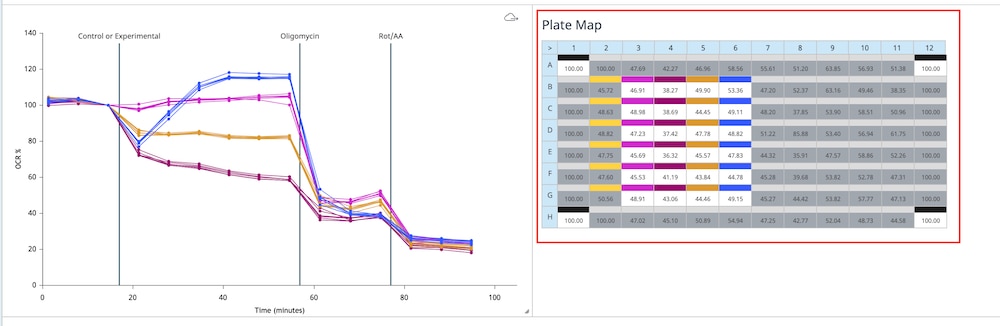
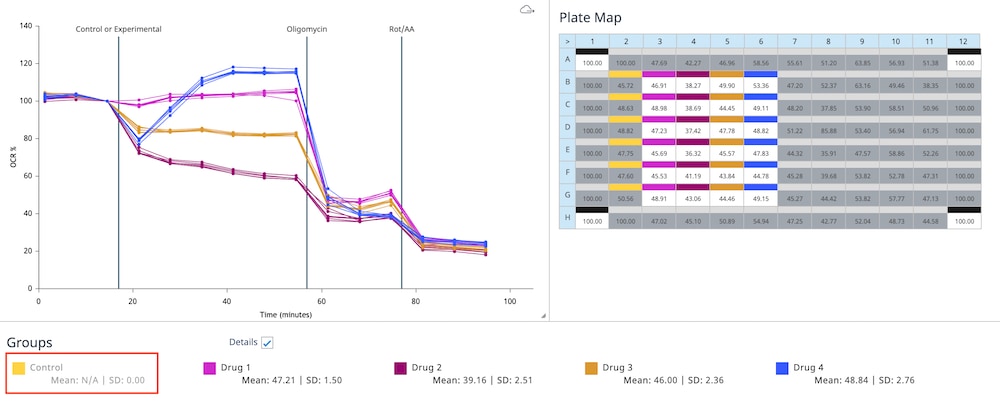
小组件下方的组列表显示了所选小组件类型的组平均值和误差数据。可以双击组名称,在小组件图中显示或隐藏该组中的所有数据。在板布局上关闭的实验孔不包括在组列表显示的值中。当从数据图中排除某个组时,该组将显示为灰色,如下图所示的“对照”组。
定义缓冲系数
一个常见的分析工作流程是为分析结果文件中的检测液和背景孔定义缓冲系数。计算质子释放率 (PER) 需要此信息,在 Seahorse Analytics 的多个检测试剂盒助手分析视图的许多小组件中都会计算和显示 PER(例如 XF T 细胞活化测定)。尝试向未正确配置缓冲系数的分析结果文件添加分析视图将导致错误消息(如下图所示)。将缓冲系数正确分配给分析结果文件中的检测液和背景孔后,可以打开所需的小组件和/或分析视图。
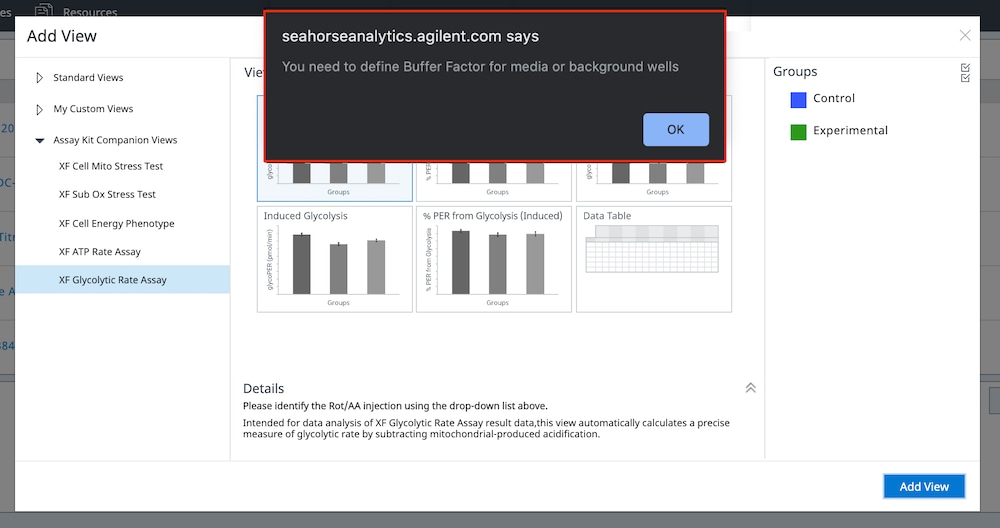
解决缓冲系数错误的步骤 — 如果在向数据文件添加第一个分析视图时出现上面所示的错误,请从下面的步骤 1 开始操作。如果已在数据文件中打开了分析视图,请从步骤 3 开始操作。
- 点击 OK(确定)以关闭错误对话框。
- 在 Add View(添加视图)窗口上,选择 Standard Views > Quick View(标准视图 > 快速视图),然后选择 OCR 动力学曲线小组件。
- 在分析视图中,点击 Modify(修改)(应用程序顶部深蓝色功能区的右上角)。
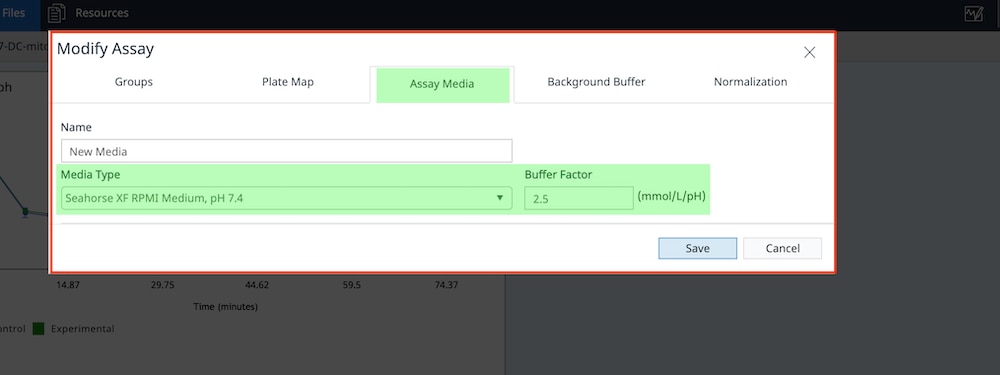
- 点击 Assay Media(检测液)选项卡,确认已向检测液组定义分配缓冲系数。如果未在此处看到缓冲系数,可以使用 Media Type(检测液类型)下拉菜单选择正确的安捷伦 Seahorse XF 检测液。
Seahorse XF RPMI 和 DMEM 培养基 (pH 7.4) 选项将自动为检测液分配缓冲系数。如果您使用的是定制检测液,则需要输入定制检测液的缓冲系数。
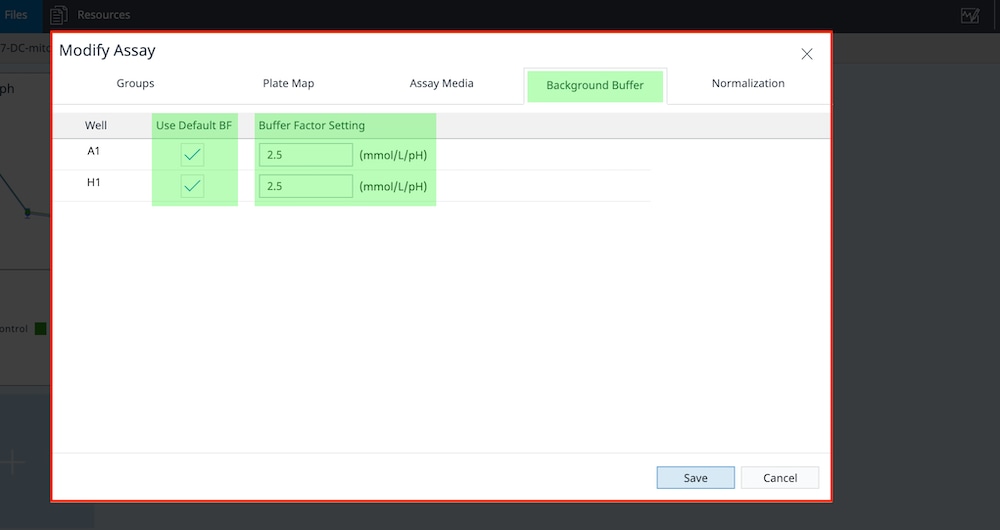
- 点击 Background Buffer(背景缓冲液)选项卡,确认已向背景孔分配缓冲系数。如果勾选了 Use Default BF(使用默认缓冲液)框以确认使用 Seahorse XF RPMI 和 DMEM 培养基 (pH 7.4),缓冲系数值将自动导入。如果您使用的是定制检测液,则需要输入定制检测液的缓冲系数。
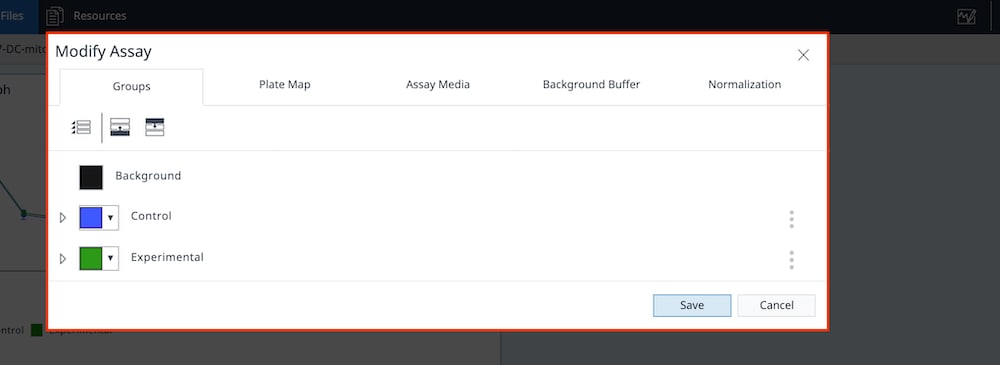
- 点击 Groups(组)选项卡,确认已将检测液分配到每个检测组。
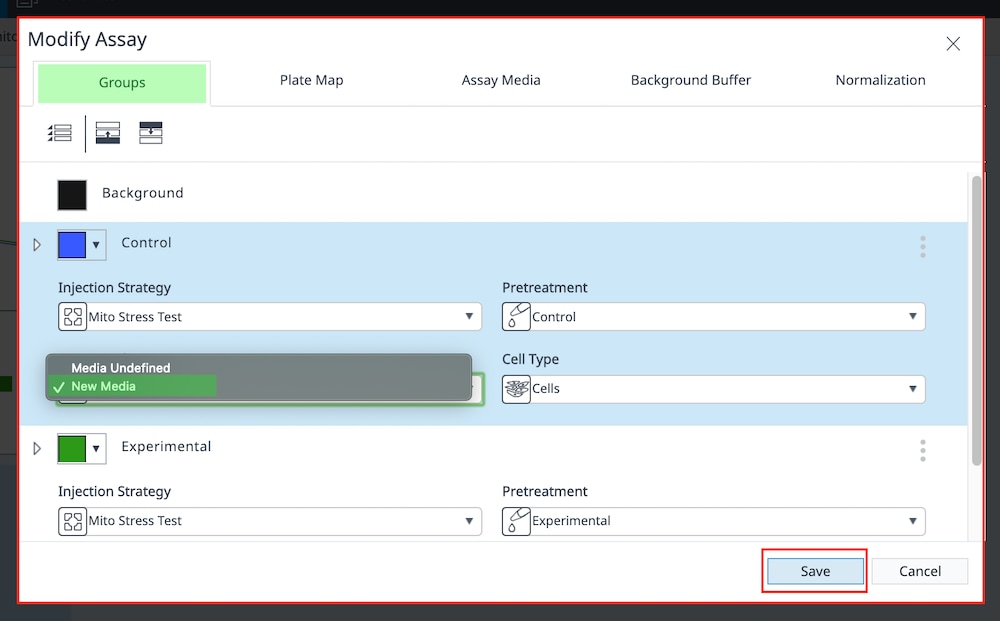
- 完成后,点击 Save(保存)。执行(或更正)上述步骤后,您应该能够将分析视图(或小组件)添加到数据文件。如果在执行这些步骤后仍出现“you need to define buffer factor for media or background groups”(您需要定义检测液或背景组的缓冲系数),请联系安捷伦细胞分析支持:cellanalysis.support@agilent.com
细胞耗氧 (O2)(呼吸)和质子 (H+) 释放(糖酵解)导致细胞周围检测液中氧和质子的浓度快速发生变化且容易测量。安捷伦 Seahorse XF 分析仪可实时测量细胞外氧和质子的浓度变化。使用 Seahorse Analytics 或 Wave Pro 软件,可以访问和查看以下类型的数据:
1. 速率数据是 Seahorse XF 分析仪的主要输出数据。Seahorse Analytics 或 Wave Pro 计算并报告的主要速率数据类型为:
耗氧率 (OCR):每孔耗氧量的定量测量值。以皮摩尔/分钟 (pmol/min) vs 时间进行报告。
反映了细胞和线粒体呼吸随时间的变化情况。
在 Rate(速率)模式下显示的耗氧率 (OCR) 数据 (A)。
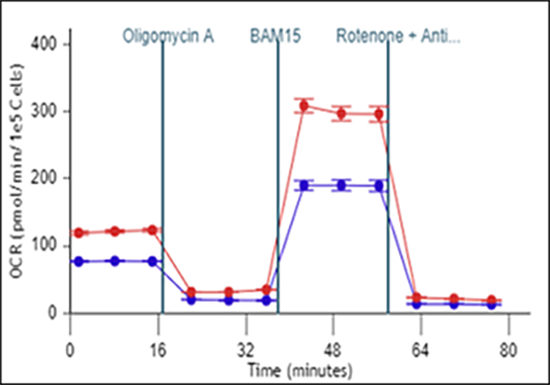
细胞外酸化率 (ECAR):细胞外检测液中质子释放情况的定性测量值,以 pH 千分之一/分钟 (mpH/min) vs 时间进行报告。
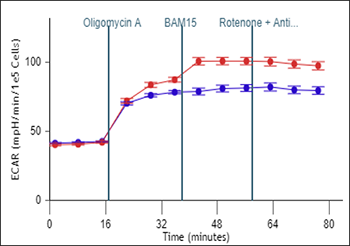
反映了细胞总体的质子释放情况,包括糖酵解与线粒体呼吸作用引起的酸化。
在 Rate(速率)模式下显示的细胞外酸化率 (ECAR) 数据 (B)。
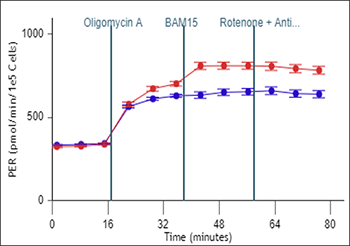
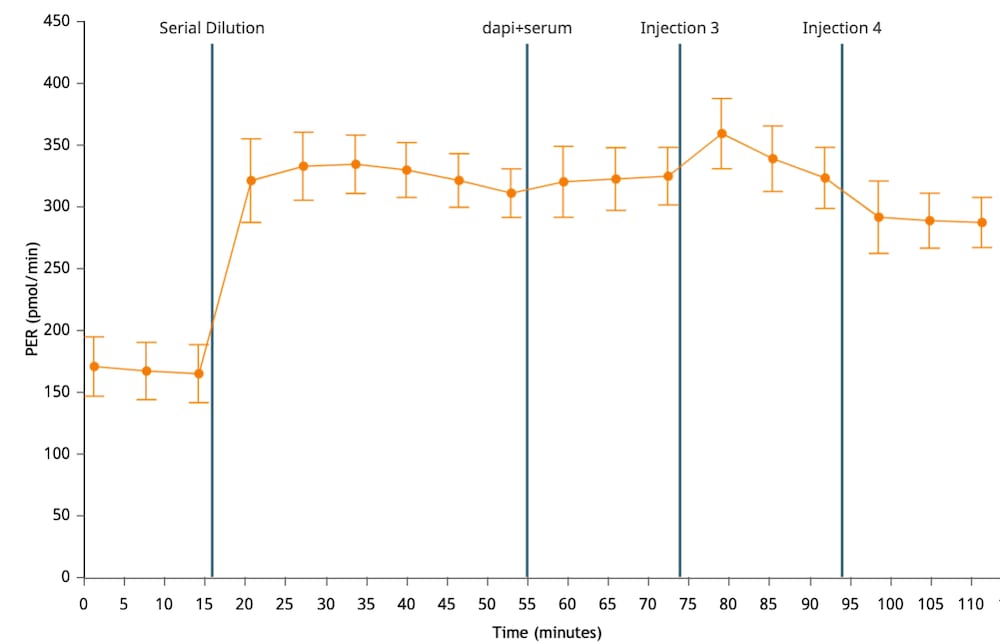
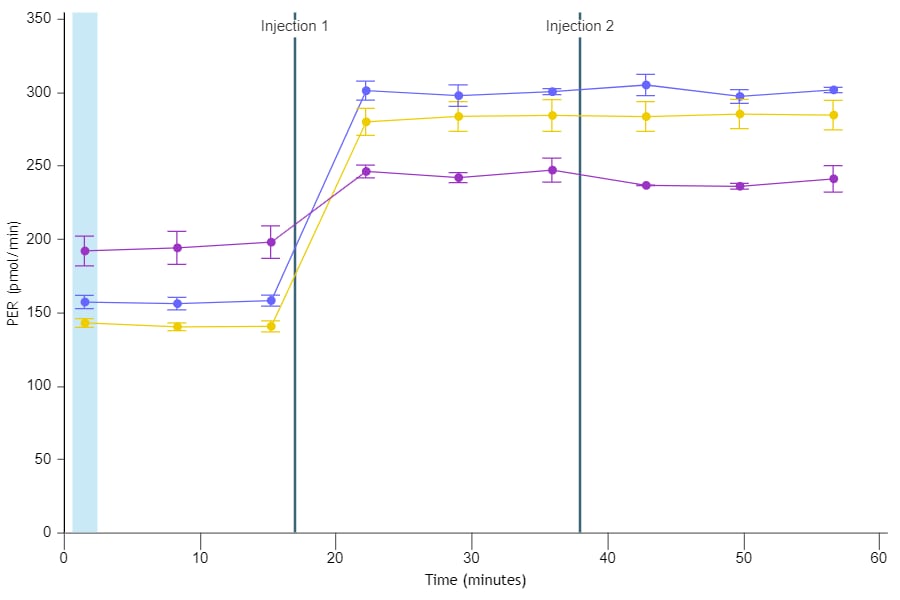
质子释放率 (PER):PER 是由 ECAR 衍生得到的细胞外总酸化程度定量指标,以皮摩尔/分钟 (pmol/min) vs 时间进行报告。PER 的计算考虑了检测液的缓冲能力和 XF 孔板的几何形状。
与 ECAR 一样,PER 反映了细胞总体的质子释放情况,包括糖酵解与线粒体呼吸作用引起的酸化。
在某些情况下(特定的 XF 试剂盒),PER 数据可进一步转换为 glycoPER 和 mitoPER,它们分别表示糖酵解和线粒体活动的 PER 定量测量值。
请注意,在检测期间不会计算 PER。PER 只能在检测结束后的实验结果分析中获得
在 Rate(速率)模式下显示的质子释放率 (PER) 数据 (C)。
注:有关转换数据(包括 ATP 产生速率)的信息,请参阅“数据分析”部分。
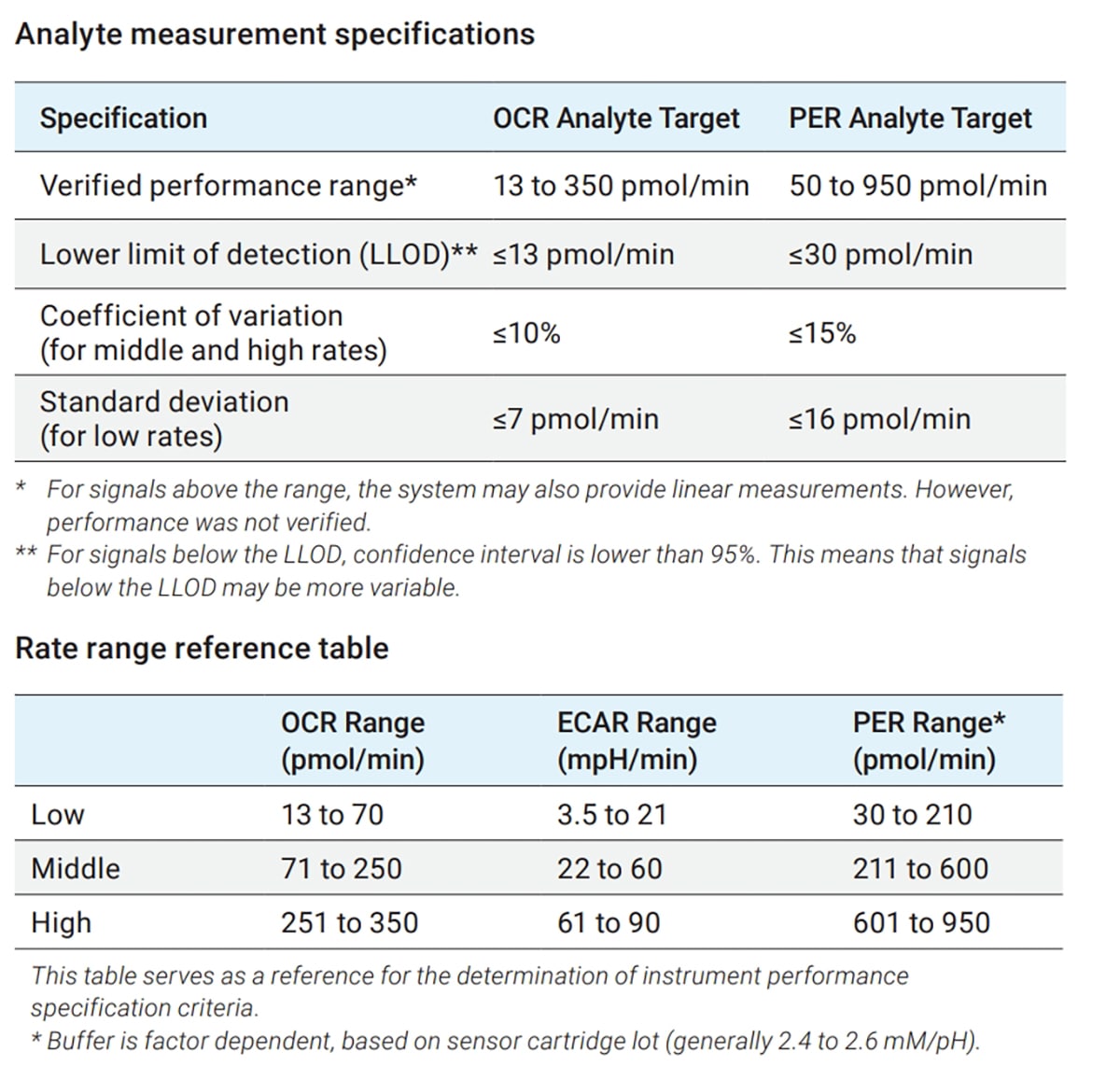
有关 OCR、ECAR 和 PER 的推荐范围(包括 U/LLOD),请参阅
O2 和 pH 水平数据分别用于计算速率数据 OCR 和 ECAR。
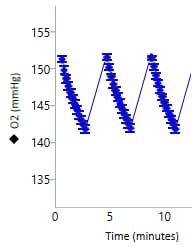
氧浓度(O2 张力,单位 mmHg):O2 水平数据与氧浓度(以 O2 张力报告,单位 mmHg)随时间的变化相关。细胞(或其他生物材料)在速率测量期间会消耗氧气,导致检测液中的氧浓度降低。
这种氧浓度的降低可用于计算耗氧率(OCR,单位 pmol/min)。
氧张力 (O2) 数据以 mmHg vs. 时间进行显示(右图)。
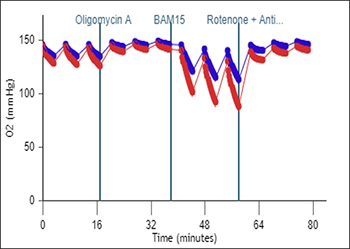
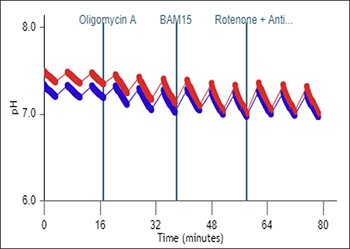
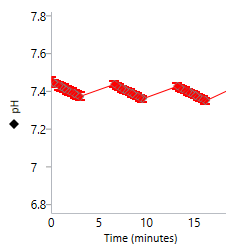
质子浓度 (pH):pH 水平数据与 H+ 浓度(以 pH 值报告)随时间的变化相关。细胞(或其他生物材料)在速率测量期间会释放质子,导致检测液中的 H+ 浓度升高。
这种质子浓度的升高可用于计算细胞外酸化率(ECAR,单位 mpH/min)。
质子浓度 (pH) 数据以 pH vs. 时间进行显示(右图)。
一般情况下:背景和样品孔(37 °C,常氧,ATM = 760 mmHg
起始 O2 = 160 mmHg +/–10 mmHg
不应低于 40 mmHg
起始 pH = 7.4 +/–0.1
不应低于 pH 6.5
如果 O2 或 pH 水平数据超出可接受范围或数值,数据 QC 功能将向用户发出警告/错误提醒。
有关 O2 和 pH 水平数据的推荐范围,请参阅
5.3 数据类型
5.3 数据质量检查
细胞耗氧(呼吸)和质子分泌(糖酵解)导致细胞外氧和质子的浓度快速发生变化且容易测量。安捷伦 Seahorse XF 分析仪可实时测量细胞外氧和质子浓度的变化。使用 Seahorse Analytics,您可以轻松访问和查看以下类型的数据:
1. 速率数据是所有 Seahorse XF 分析仪的主要输出数据。Seahorse Analytics 计算并报告的 3 类速率数据为:
耗氧率 (OCR):对孔内样品的耗氧量进行定量测量,从而测量随时间变化的细胞和线粒体呼吸情况。以皮摩尔/分钟 (pmol/min) vs 时间进行报告。耗氧率 (OCR) 数据显示在 Rate(速率)模式下(右图)。当您使用 Add Widget(添加小组件)功能向分析视图中添加动力学曲线时,默认显示的速率为 OCR。
重要!对于未包被的细胞板,建议的(XFe96、XFe24、XFp、XF HS Mini)一般 OCR 数据范围为:
- 背景孔:37 °C 下为 0 ± 20 (pmol/min)
- 实验孔:37 °C 下为 20–160/50–400 (pmol/min)(基线测量)。
请注意,这些值是一般建议值,根据检测和/或分析的细胞类型不同可能有所不同。
细胞外酸化率 (ECAR):细胞外检测液中质子释放随时间的定性测量值,以 pH 千分之一/分钟 (mpH/min) vs 时间进行报告。细胞外酸化率 (ECAR) 数据显示在 Rate(速率)模式下(右图)。您可以使用动力学曲线上方的 Rate(速率)下拉菜单控件在动力学曲线小组件编辑器视图上显示 ECAR 数据。
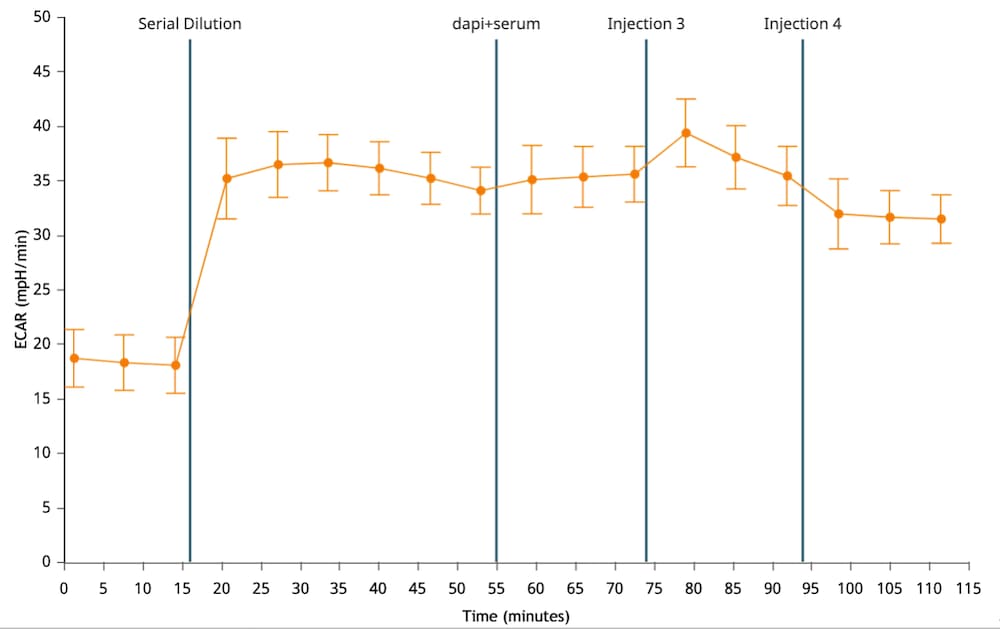
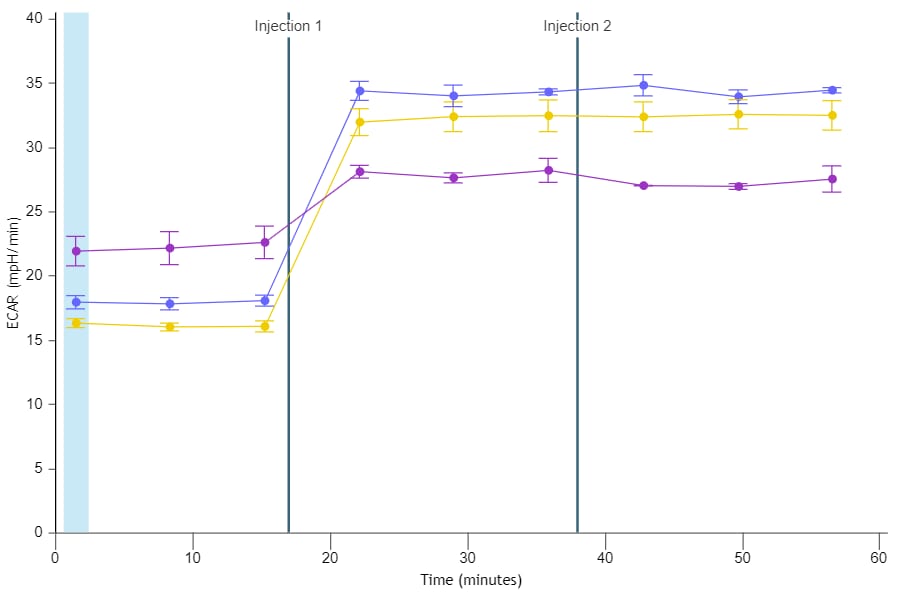
重要!对于未包被的细胞板,(XFe96、XFe24、XFp、XF HS Mini)ECAR 数据的一般范围为:
- 背景孔:37 °C 下为 0 ± 10 (mpH/min)
- 实验孔:37 °C 下为 10–90/20–120 (mpH/min)(基线测量)。
请注意,这些值是一般建议值,根据检测和/或分析的细胞类型不同可能有所不同。
质子释放率 (PER):细胞外酸化程度的定量指标,考虑了检测液缓冲能力和孔板几何形状。以皮摩尔/分钟 (pmol/min) vs 时间进行报告。只能在运行后的实验结果分析中获得。在分析运行期间不会计算 PER。您可以使用动力学曲线上方的 Rate(速率)下拉菜单控件在动力学曲线小组件编辑器视图上显示 PER 数据。
2. 水平数据用于计算速率数据并用于数据质量评估 — 通常是 XF 分析工作流程的第一步。
氧浓度(O2 张力,单位 mmHg):细胞(或其他生物材料)在速率测量期间会消耗氧气,导致检测液中的氧浓度降低。这种氧浓度的降低可用于计算耗氧率(OCR,单位 pmol/min)。您可以通过将动力学曲线上方的 Y1 切换至 Level(水平),在动力学曲线小组件编辑器视图上显示氧张力水平数据。氧张力 (O2) 数据以 mmHg vs. 时间进行显示(右图)。
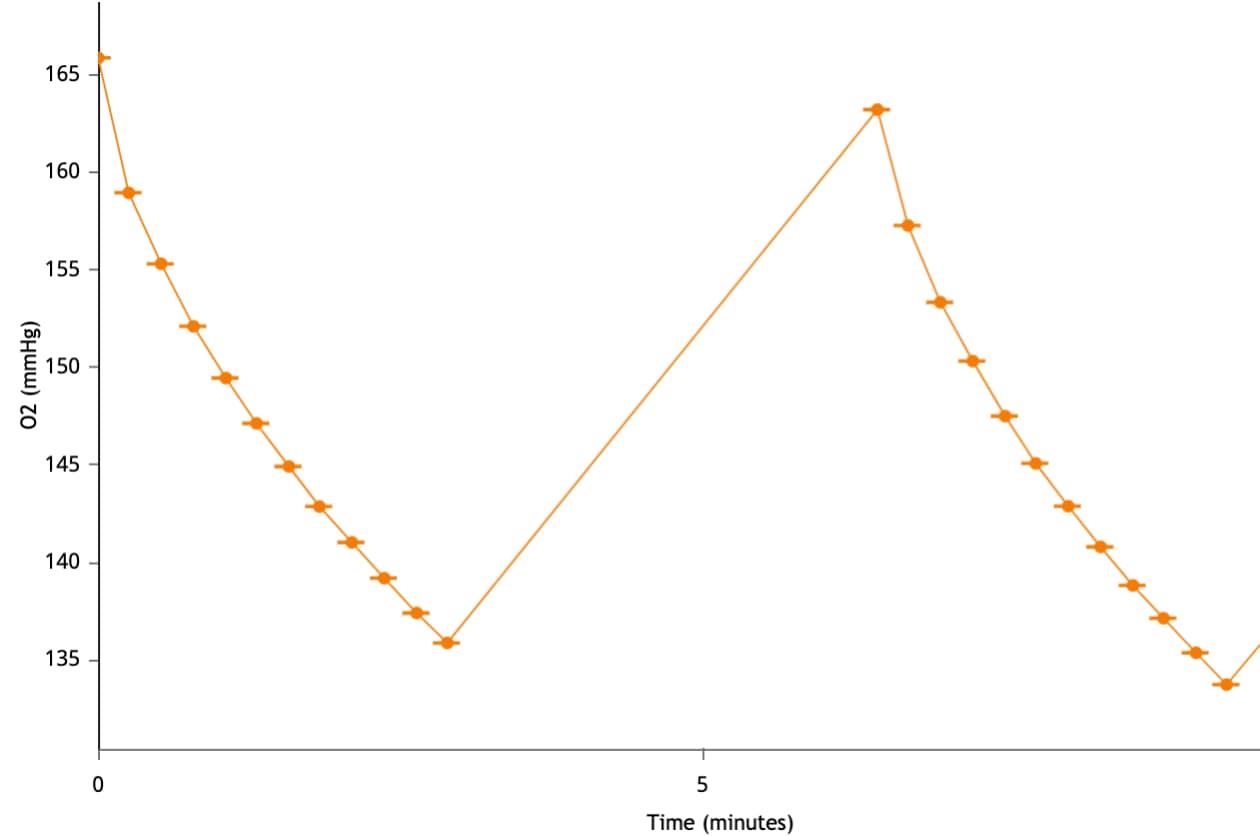
重要!建议检查每个分析结果文件的氧张力 (O2) 水平数据。使用未包被的细胞板时,建议的起始氧张力 (O2) 水平数据为:
- 背景孔:37 °C 下为 152 ± 10 (mmHg)
- 实验孔:37 °C 下为 152 ± 10 (mmHg)
- 测量周期结束时的氧张力不应低于 2040 mmHg
- 下一测量周期开始时的氧张力应与前一次测量的起始氧张力相等。
请注意,这些值是一般建议值,根据检测和/或分析的细胞类型不同可能有所不同。
质子浓度 (pH):细胞(或其他生物材料)在速率测量期间会排出质子,导致检测液中的质子浓度升高。测量整个 XF 分析过程中微室内的质子浓度,并作为细胞外酸化率(ECAR,单位 mpH/min)进行计算。您可以首先使用 Rate(速率)下拉菜单选择 ECAR,然后使用动力学曲线上方的控件将 Y1 切换至 Level(水平),在动力学曲线小组件编辑器视图上显示质子浓度。质子浓度 (pH) 数据以 pH vs. 时间进行显示(右图)。
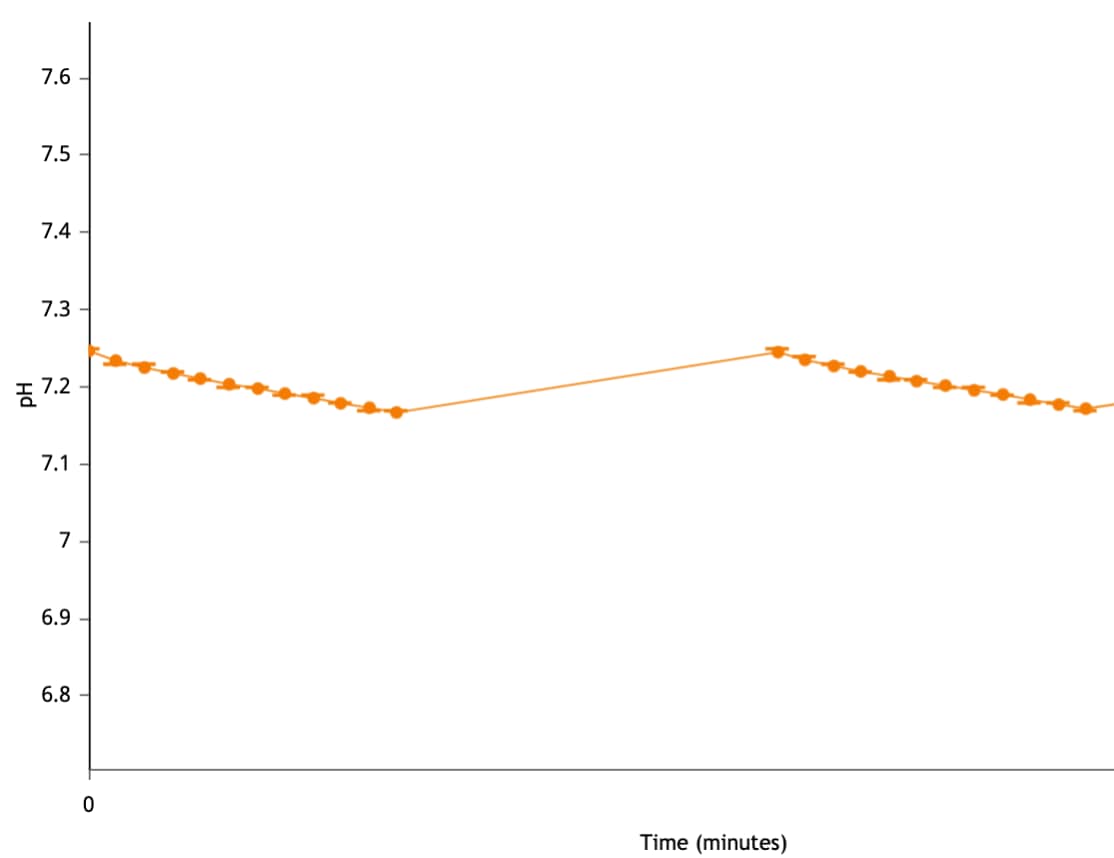
重要!建议检查每个分析结果文件的质子浓度 (pH) 水平数据。使用未包被的细胞板和安捷伦 Seahorse XF DMEM 或 XF RPMI 培养基,pH 7.4时,建议的起始质子浓度 (pH) 水平数据范围为:
- 背景孔:37 °C 下 [pH] 为 7.4 ± 0.1
- 实验孔:37 °C 下 [pH] 为 7.4 ± 0.1
- 测量周期结束时的 pH 值不应低于 pH 6.4
- 下一测量周期开始时的 pH 应与前一次测量的起始 pH 值相等。
请注意,这些值是一般建议值,根据检测和/或分析的细胞类型不同可能有所不同。
相关支持材料
参考资料
在进行 XF 数据分析和/或转换之前,建议首先检查数据文件的数据质量和技术准确性。
数据质量分析视图是安捷伦 Seahorse Analytics 网页版软件和安捷伦 Seahorse Wave Pro 软件中的一项分析功能。该软件功能可自动检查 XF 分析过程中采集的数据,识别潜在的异常值或问题。
系统将执行超过 25 项不同的数据质量测试;任何孔的数据若超出警告和/或错误测试阈值,将被标记为待审查,用户可直接在数据质量分析视图中进行处理(例如,从组中剔除该孔,或对其进行标记以便后续进行额外的数据审查)。
数据 QC 包括针对以下几个方面的主要测试和后续测试:
- 温度范围
- 正确的校准
- 准确的背景信号
- O2 和 pH 水平数据
- OCR、ECAR 和 PER 数据
- 加药性能
数据质量分析视图用于分析按照标准 XF 检测工作流程参数(温度 37 °C、常氧条件等)生成的数据文件,不适用于分析在非 37 °C、缺氧状态或使用 3D 生物材料生成的数据文件。
有关执行的数据 QC 测试的完整列表以及数据 QC 功能的使用说明,请参阅:
安捷伦 Seahorse Wave Pro 和安捷伦 Seahorse Analytics 软件中的数据质量分析视图
5.4 数据显示选项
5.4 数据分析
Seahorse Analytics 分析视图在一个页面中集成了多个小组件(图)。建议与所支持的安捷伦 Seahorse XF 检测工作流程和方案相对应的检测试剂盒助手分析视图配合使用。
Assay Kit Companion Analysis View » XF Real-Time ATP Rate Assay(检测试剂盒助手分析视图 » XF 实时 ATP 速率测定):按照下面的步骤在单个分析视图中计算并显示 XF 实时 ATP 速率测定参数。请注意,必须正确配置缓冲系数,才能将此分析视图和此分析视图的小组件添加到分析结果文件中。
- 在 Add View(添加视图)窗口中,点击 Assay Kit Companion View(检测试剂盒助手视图)列表以展开选项列表。
- 点击 XF ATP Rate Assay(XF ATP 速率测定)分析视图以显示检测参数小组件。
- 对于诱导 XF ATP 速率测定(寡霉素和鱼藤酮/抗霉素 A 标准加药前进行 1 或 2 次加药),必须使用小组件上方的下拉菜单确定寡霉素加药是第 2 次还是第 3 次,然后才能添加此分析视图。这一步非常重要,只有正确选择了哪一次是寡霉素加药才能正确计算检测参数;寡霉素加药选择错误将导致小组件计算和图形不正确。有关这两个工作流程的更多信息,请参阅 XF 实时 ATP 速率测定用户手册。
- 选择所需的参数小组件添加到分析视图。小组件周围的蓝色轮廓表示其已被选中。如果小组件呈灰色,则不能选择,因为分析文件不满足计算参数所需的最少加药次数要求。
- 如有必要,在组列表中关闭/打开组,然后点击 Add View(添加视图)
Assay Kit Companion Analysis View » XF Cell Mito Stress Test(检测试剂盒助手分析视图 » XF 细胞线粒体压力测试):要在单个分析视图中计算并显示 XF 细胞线粒体压力测试检测参数:
- 在 Add View(添加视图)窗口中,点击 Assay Kit Companion View(检测试剂盒助手视图)列表以展开选项列表。
- 点击 XF Cell Mito Stress Test(XF 细胞线粒体压力测试)分析视图以显示检测参数小组件。
- 重要提示:对于涉及 4 次加药的 XF 细胞线粒体压力测试,必须使用小组件上方的下拉菜单确定哪一次是寡霉素,然后才能添加此分析视图。这一步骤非常重要,因为正确选择了哪一次是寡霉素加药才能正确计算检测参数;寡霉素加药选择错误将导致小组件计算和图形不正确。
- 选择所需的参数小组件(例如基础呼吸、最大呼吸等)添加到分析视图。小组件周围的蓝色轮廓表示其已被选中。如果 Acute Response(急性响应)小组件呈灰色,则不能选择,因为该参数仅适用于急性加药的 XF 细胞线粒体压力测试分析。
- 如有必要,在组列表中关闭/打开组,然后点击 Add View(添加视图)
Assay Kit Companion Analysis View » XF Glycolytic Rate Assay(检测试剂盒助手分析视图 » XF 糖酵解速率测定):按以下步骤在单个分析视图中计算并显示 XF 糖酵解速率测定参数。请注意,必须正确配置缓冲系数,才能将此分析视图和此分析视图的小组件添加到分析结果文件中。
- 在 Add View(添加视图)窗口中,点击 Assay Kit Companion View(检测试剂盒助手视图)列表以展开选项列表。
- 点击 XF Glycolytic Rate Assay(XF 糖酵解速率测定)分析视图以显示检测参数小组件。
- 对于诱导 XF 糖酵解速率测定(鱼藤酮/抗霉素 A 和 2-DG 标准加药之前进行 1 或 2 次加药),必须使用小组件上方的下拉菜单确定哪一次是鱼藤酮/抗霉素-A 加药,然后才能添加此分析视图。这一步非常重要,只有正确选择了哪一次是鱼藤酮/抗霉素-A 加药才能正确计算检测参数;鱼藤酮/抗霉素-A 加药选择错误将导致小组件计算和图形不正确。有关这两个工作流程的更多信息,请参阅 XF 糖酵解速率测定用户手册。
- 选择所需的参数小组件添加到分析视图。小组件周围的蓝色轮廓表示其已被选中。如果小组件呈灰色,则不能选择,因为分析文件不满足计算参数所需的最少加药次数要求。
- 如有必要,在组列表中关闭/打开组,然后点击 Add View(添加视图)
安捷伦 Seahorse Analytics 提供一系列图表类型,可根据选择的分析视图类型来分析和解析分析结果数据。有关创建和自定义分析视图的更多信息,请参阅“分析视图”部分。
1. 小组件类型 — 动力学曲线:动力学曲线是显示 XF 结果数据最常用的一种方式,其中 x 轴为时间(单位为分钟),y 轴为被测分析物浓度的变化率(O2 或 H+)。可以在动力学曲线小组件的 y 轴上显示的两种数据类型是:(1) 速率数据 — 耗氧量 (OCR)、细胞外酸化 (ECAR)、质子释放 (PER) 以及 (2) 水平数据 — 氧张力 (mmHg) 或质子浓度 [mpH]。
- Add Widget > Standard Graphs » Kinetics Graph(添加小组件 > 标准图 » 动力学曲线):
使用 Standard Graphs » Kinetics Graph(标准图 » 动力学曲线)创建所选速率类型(OCR、ECAR、PER)和测量值的曲线图。
通过点击 Add Widget(添加小组件)按钮(如右图红色框所示)并选择 Kinetic Graph(动力学曲线,位于 Standard Graphs(标准图)列表中),可以将动力学曲线小组件添加到 Seahorse Analytics 的任何分析视图中。


注:您还可以将几个专门的动力学曲线添加到自定义视图中,专用于分析 XF 实时 ATP 速率测定结果数据 — 线粒体呼吸 ATP 产生速率、糖酵解 ATP 产生速率和总 ATP 产生速率。您可以通过点击 Add Widget(添加小组件)并展开 XF ATP 速率测定的小组件选项列表(右图)找到这些小组件。有关这些动力学曲线中计算的数据的更多信息,请参阅此白皮书。
2. 小组件类型 — 条形图:条形图是呈现 XF 数据的另一种常见方式,可帮助用户进行常规 XF 分析,例如确定最佳 FCCP 浓度和细胞接种密度。Seahorse Analytics 提供了多种条形图选项,可添加到分析视图中,其中许多都是分析特定的。有关特定条形图小组件的更多信息,请参阅此处或 Seahorse Analytics 中的特定检测试剂盒助手分析视图。
- Add Widget > Standard Graphs » Kinetics Graph(添加小组件 > 标准图 » 条形图):
使用 Standard Graphs » Bar Chart widget(标准图 » 条形图小组件)创建所选速率类型(OCR、ECAR、PER)和测量值的条形图。
例如,要显示所有组的速率测量 10 的 OCR 数据:
- 点击 Add Widget(添加小组件)按钮
- 展开 Standard Graphs(标准图)列表
- 选择 Bar Chart(条形图)
- 点击 Add Widget(添加小组件)
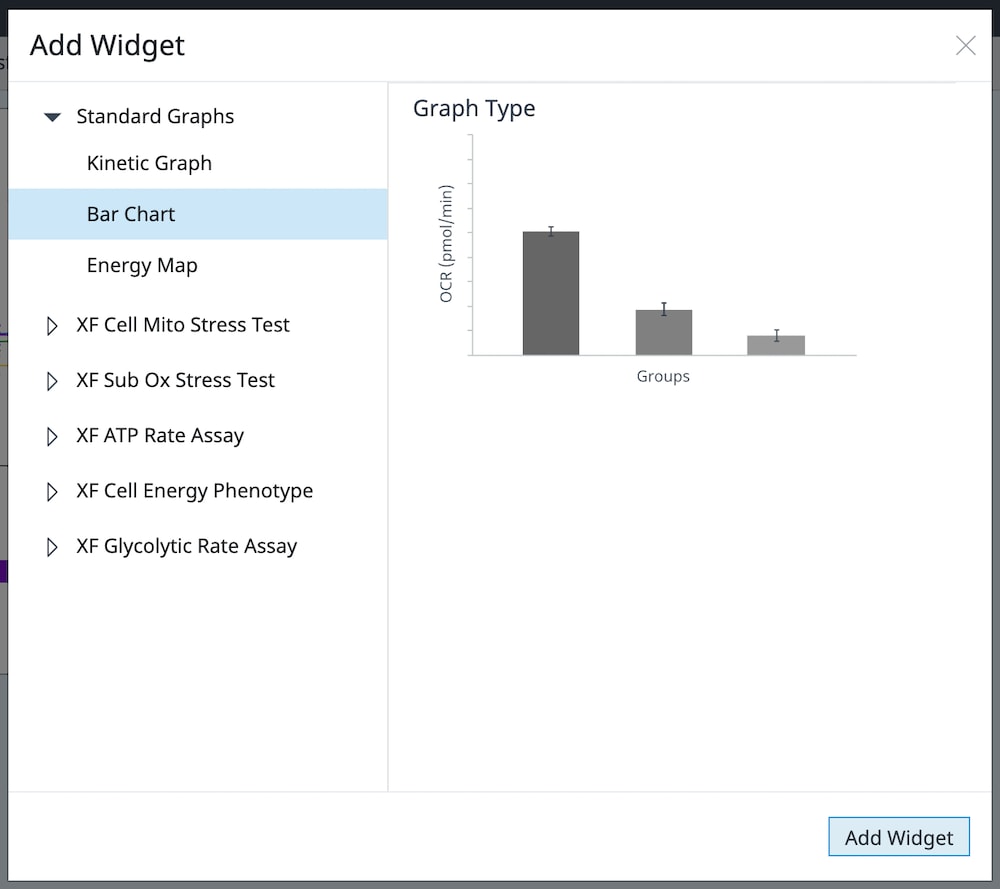
在小组件编辑器视图上,使用 Rate(速率)下拉菜单选择速率测量 10,然后点击返回箭头(小组件编辑器视图的左上角)返回分析视图。

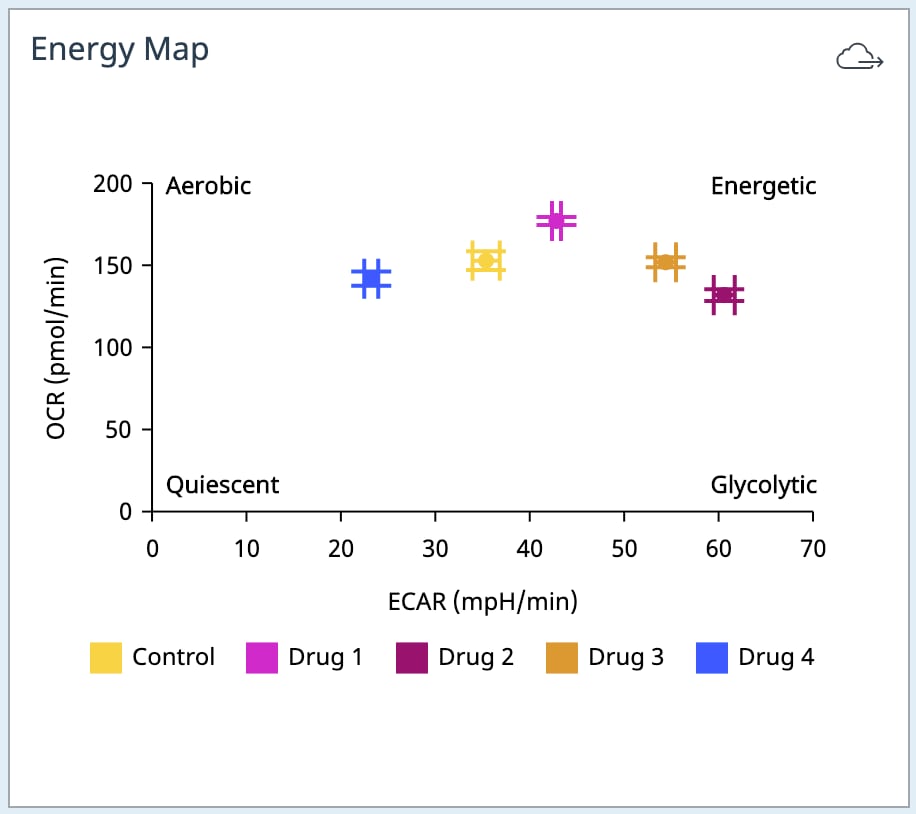
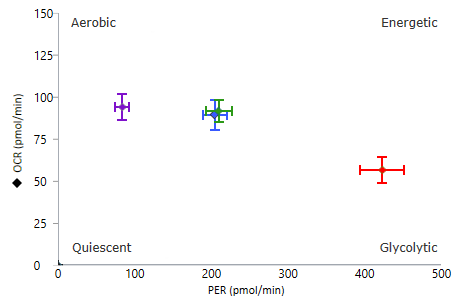
3. 小组件类型 — 能量图:能量图小组件是 X 和 Y 散点图,可用于比较所有组或选定组中选定速率测量的两种类型的速率数据。除了下面介绍的能量图小组件之外,还有其他几种散点图小组件选项可添加到分析视图中,这些选项是根据不同的分析类型而定的,并在分析视图部分进行了定义。
- Add Widget > Standard Graphs » Energy Map(添加小组件 > 标准图 » 能量图):
使用 Standard Graphs » Energy Map(标准图 » 能量图)小组件来创建耗氧率数据 (OCR) 在 y 轴上的散点图,酸化率数据 (ECAR 或 PER) 在 x 轴上的散点图,描绘每个组选定速率测量的相对通路利用率。
使用 Measurement(测量)下拉菜单以显示分析中另一个速率测量的组数据。
使用 Rate(速率)下拉菜单将 x 轴上的酸化率更改为 PER(或 ECAR);OCR 始终在 y 轴上显示。
- Add Widget > XF ATP Rate Assay » Energetic Map (Basal)(添加小组件 > XF ATP 速率测定 » 能量图(基础))小组件:
能量图(基础)数据小组件位于 XF ATP 速率测定小组件列表中,可用于分析安捷伦 Seahorse XF 实时 ATP 速率测定的标准和诱导工作流程数据。有关这两个工作流程的更多信息,请参阅 XF 实时 ATP 速率测定用户手册。另请注意,必须为检测液、背景孔和实验组分配正确的缓冲系数,以计算该小组件数据。
Energetic Map (Basal)(能量图(基础))小组件的 y 轴为基础线粒体呼吸 ATP 产生速率,x 轴为基础糖酵解 ATP 产生速率(下图,左)。小组件使用的计算可在 Add Widget(添加小组件)对话框(右图)上的详细信息中找到。
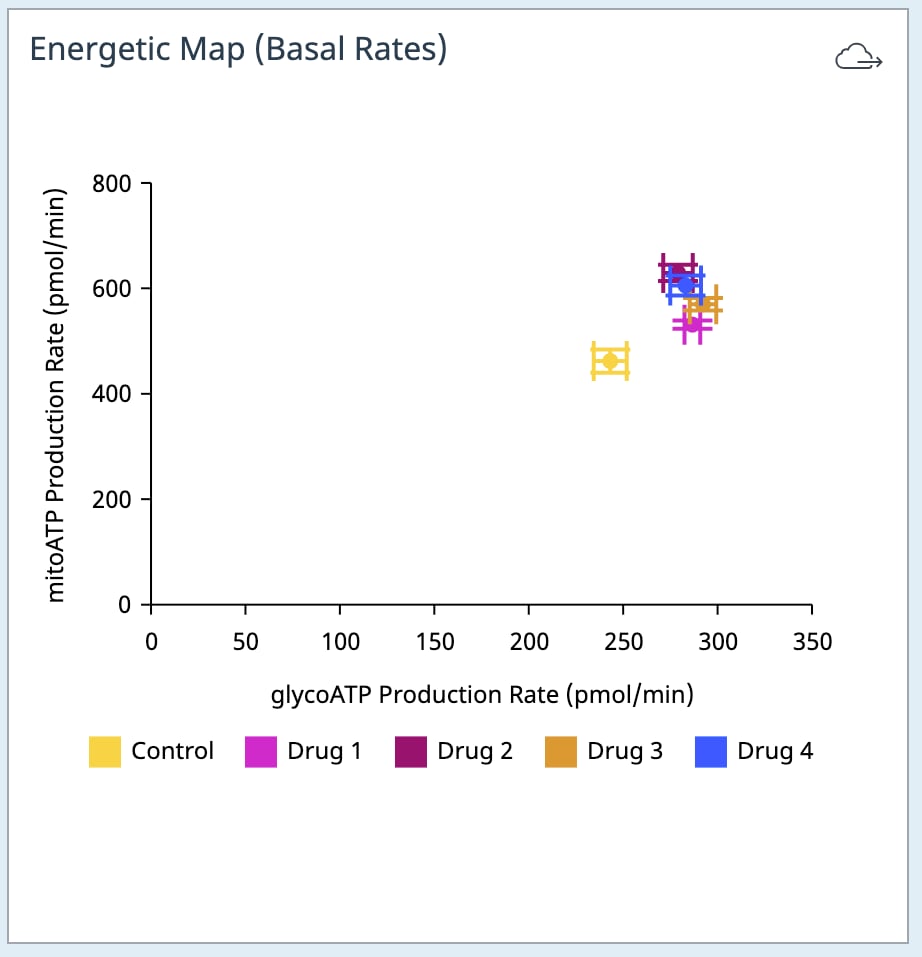
对于超过 2 次加药的 XF ATP 速率测定,您必须使用 Add Widget(添加小组件)(右图)上的下拉菜单确定哪一次是寡霉素加药,然后才能将此小组件添加到分析视图。为什么呢?因为确定了哪一次是寡霉素加药,才能正确计算基础 ATP 产生速率,并显示在小组件上,所以这非常重要。寡霉素加药选择错误将导致计算结果和数据不正确。
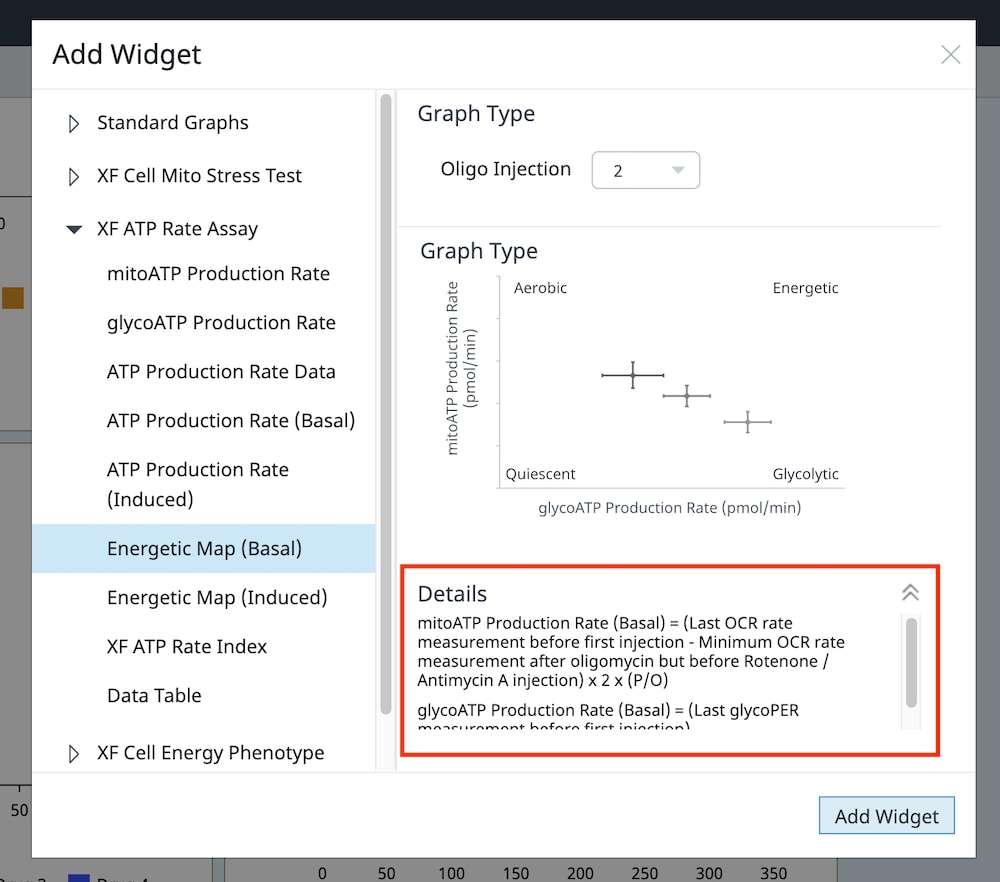
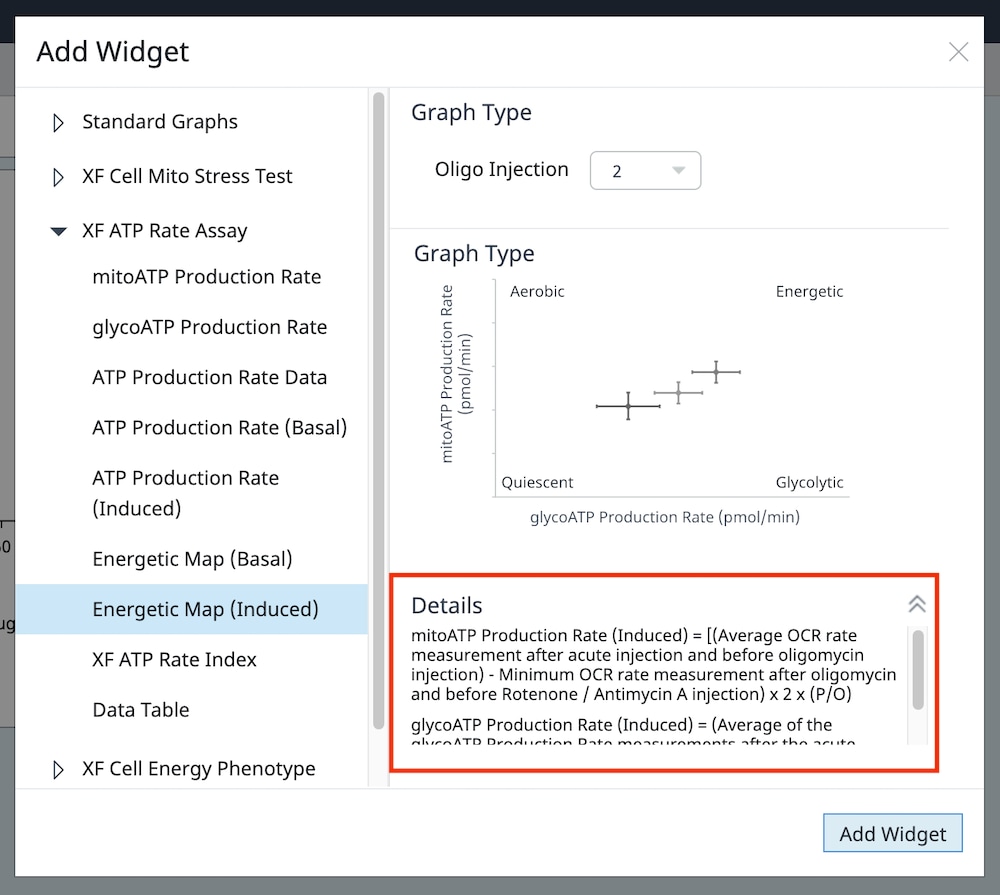
- Add Widget > XF ATP Rate Assay » Energetic Map (Induced)(添加小组件 > XF ATP 速率测定 » 能量图(诱导))小组件:
能量图(诱导)数据小组件也可以在 XF ATP 速率测定小组件列表中找到,但仅可应用于安捷伦 Seahorse XF 实时 ATP 速率测定的诱导检测工作流程。有关诱导检测工作流程的更多信息,请参阅 XF 实时 ATP 速率测定用户手册。另请注意,必须为检测液、背景孔和实验组分配正确的缓冲系数,然后才能计算该小组件数据。
Energetic Map (Induced)(能量图(诱导))小组件的 y 轴为诱导线粒体呼吸 ATP 产生速率,x 轴为诱导糖酵解 ATP 产生速率(右图)。小组件使用的计算可在 Add Widget(添加小组件)对话框(下图,右)上的详细信息中找到。
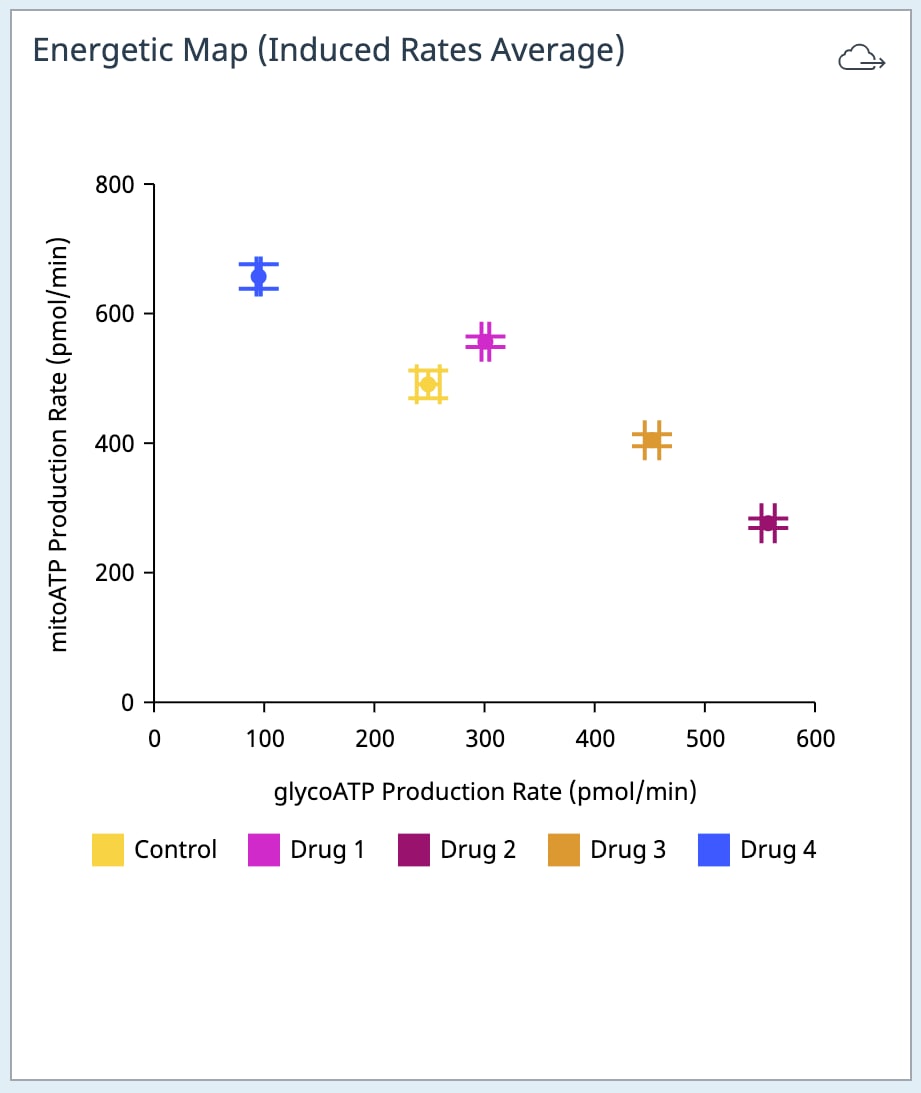
对于存在 3+ 次加药的 XF ATP 速率测定,您必须使用 Add Widget(添加小组件)(右图)上的下拉菜单确定哪一次是寡霉素加药,然后才能将此小组件添加到分析视图。为什么呢?因为确定了哪一次是寡霉素加药,才能正确计算诱导 ATP 产生速率,并显示在小组件上,所以这非常重要。寡霉素加药选择错误将导致计算结果和数据不正确。
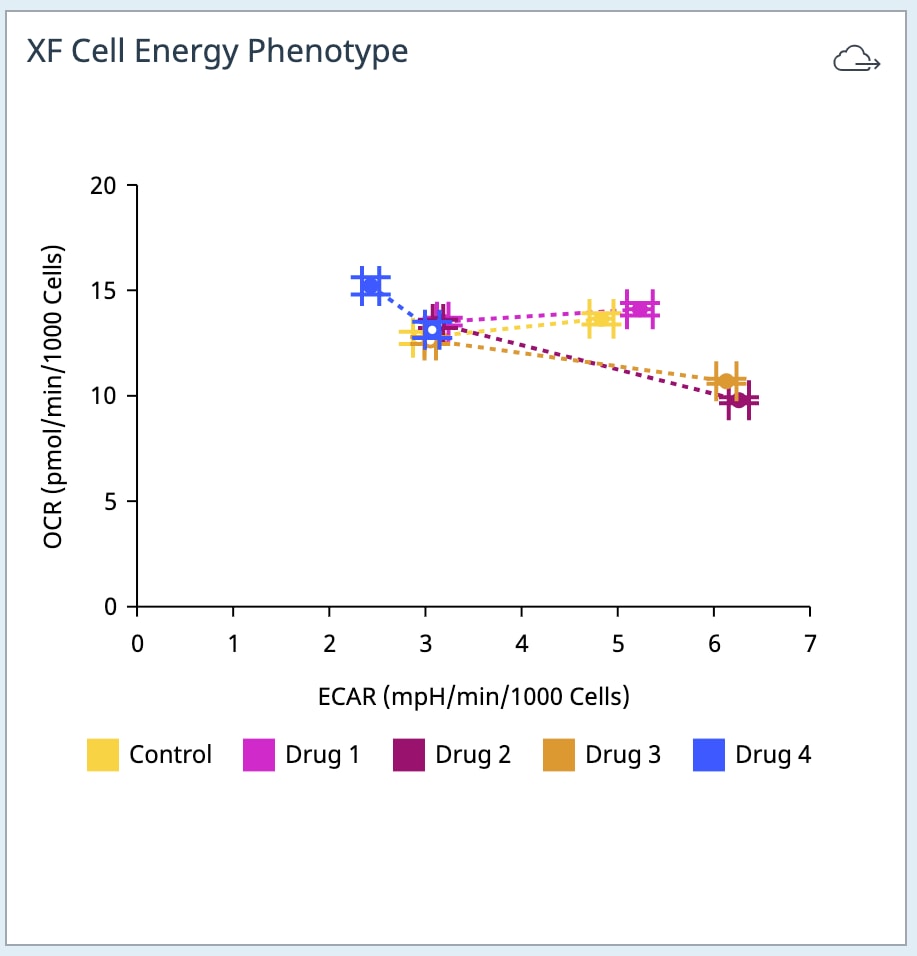
- Add Widget > XF Cell Energy Phenotype Test » XF Cell Energy Phenotype(添加小组件 > XF 细胞能量代谢表型测试 » XF 细胞能量代谢表型)小组件:XF 细胞能量代谢表型数据小组件位于 XF 细胞能量代谢表型小组件列表中,用于分析 XF 细胞能量代谢表型测试数据。
- 与 Seahorse Analytics 中的其他散点图小组件选项相比,这是一个独特的小组件,因为它每组绘制 2 个数据点 — 基线表型和应激表型,通过称为代谢潜能的虚线连接 — y 轴始终为 OCR,x 轴始终为 ECAR(下图)。
- 有关在此小组件中执行的计算的更多信息,请参阅 Add Widget(添加小组件)的 Details(详细信息)部分或 XF 细胞能量代谢表型测试试剂盒用户手册)。
- 小组件类型 — 其他:除了动力学曲线、条形图和散点图小组件外,Seahorse Analytics 还提供专门针对标准和/或诱导 XF 实时 ATP 速率测定工作流程的两个小组件。有关这两个工作流程的更多信息,请参阅 XF 实时 ATP 速率测定用户手册。另请注意,必须为检测液、背景孔和实验组分配正确的缓冲系数,然后才能计算该小组件数据。
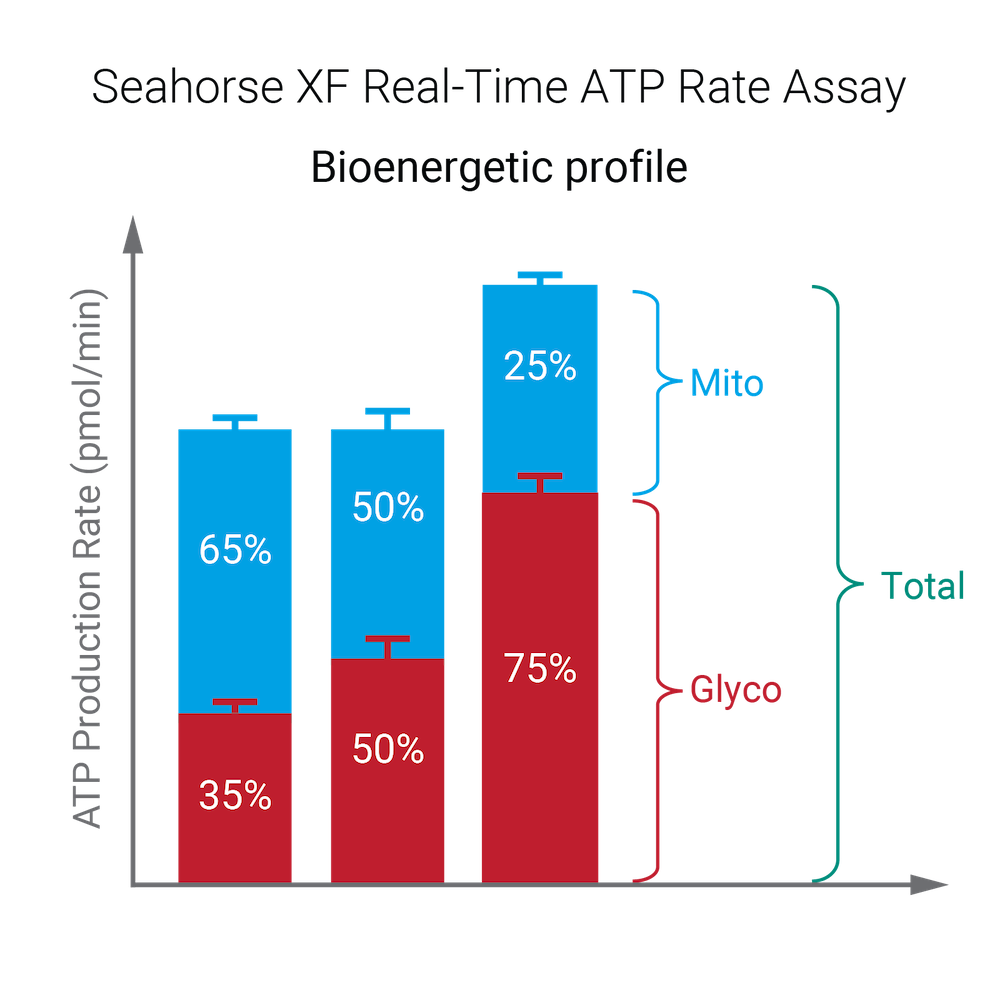
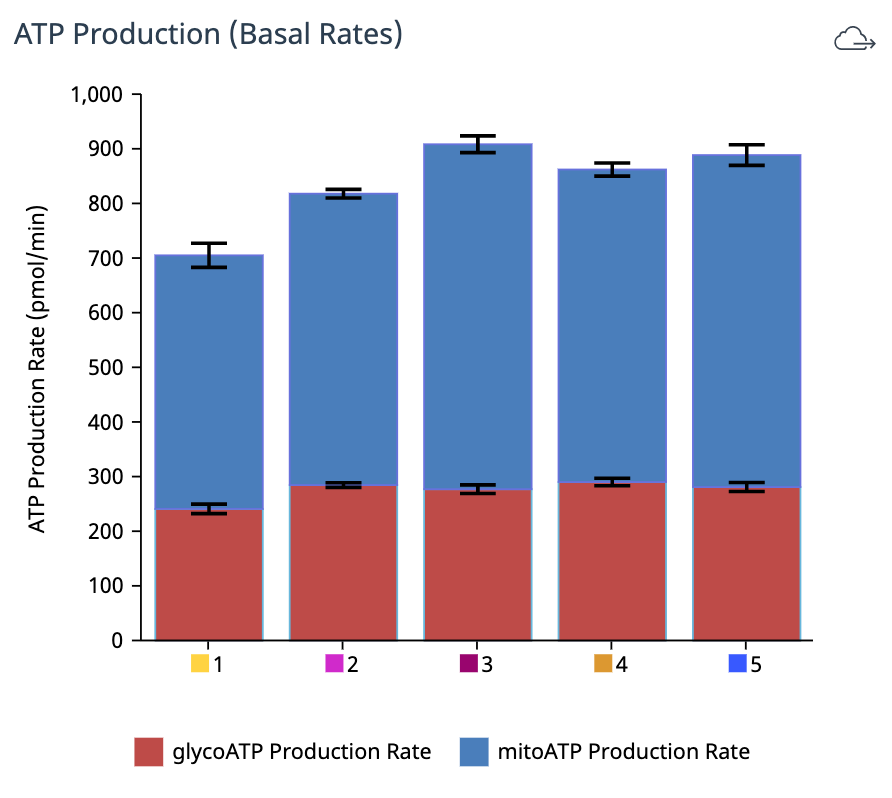
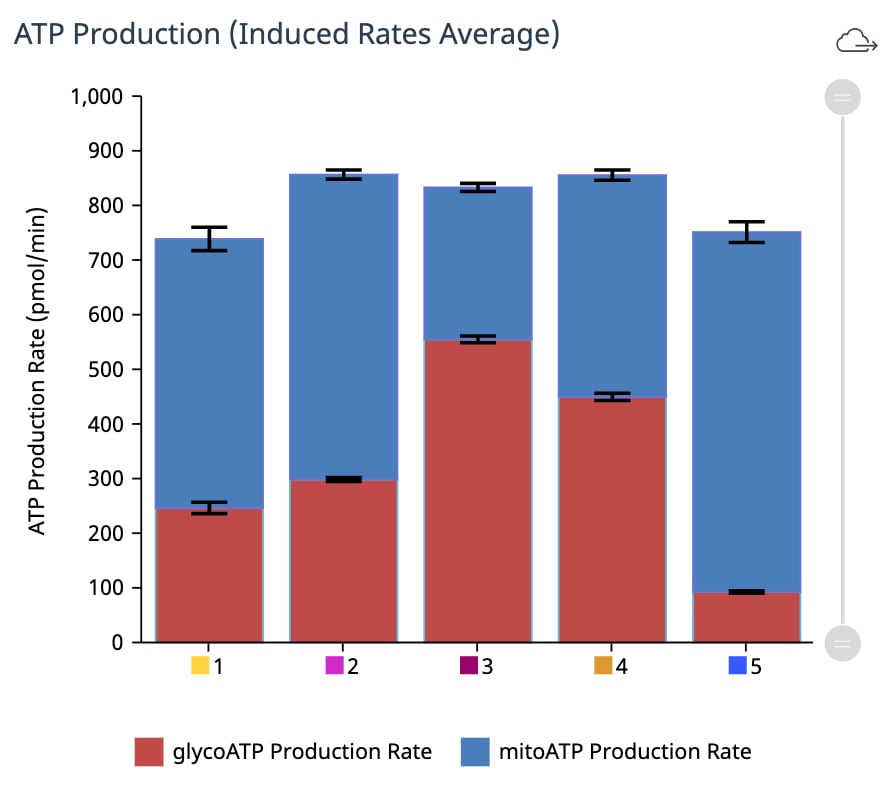
对于超过 2 次加药的 XF ATP 速率测定,您必须使用 Add Widget(添加小组件)对话框上的下拉菜单确定哪一次是寡霉素加药,然后才能将此小组件添加到分析视图。为什么呢?因为确定了哪一次是寡霉素加药,才能正确计算 ATP 产生速率,并显示在小组件上,所以这非常重要。寡霉素加药选择错误将导致计算结果和数据不正确。- Add Widget > XF ATP Rate Assay » Stacked bar chart(添加小组件 > XF ATP 速率测定 » 堆积条形图):当前可在 XF ATP 速率测定小组件列表中找到堆积条形图小组件。ATP Production Rate (Basal)(ATP 产生速率(基础))小组件可为各组创建基础糖酵解 ATP 产生速率(上方蓝色条)和基础线粒体呼吸 ATP 产生速率(下方红色条)的堆积条形图(下图,左)。此小组件适用于标准和诱导检测工作流程。
ATP Production Rate (Induced)(ATP 产生速率(诱导))小组件可为各组创建诱导糖酵解 ATP 产生速率平均值(上方蓝色条)和诱导线粒体呼吸 ATP 产生速率平均值(下方红色条)的堆积条形图(下图,右)。此小组件仅适用于诱导检测工作流程。
- Add Widget > XF ATP Rate Assay » Stacked bar chart(添加小组件 > XF ATP 速率测定 » 堆积条形图):当前可在 XF ATP 速率测定小组件列表中找到堆积条形图小组件。ATP Production Rate (Basal)(ATP 产生速率(基础))小组件可为各组创建基础糖酵解 ATP 产生速率(上方蓝色条)和基础线粒体呼吸 ATP 产生速率(下方红色条)的堆积条形图(下图,左)。此小组件适用于标准和诱导检测工作流程。
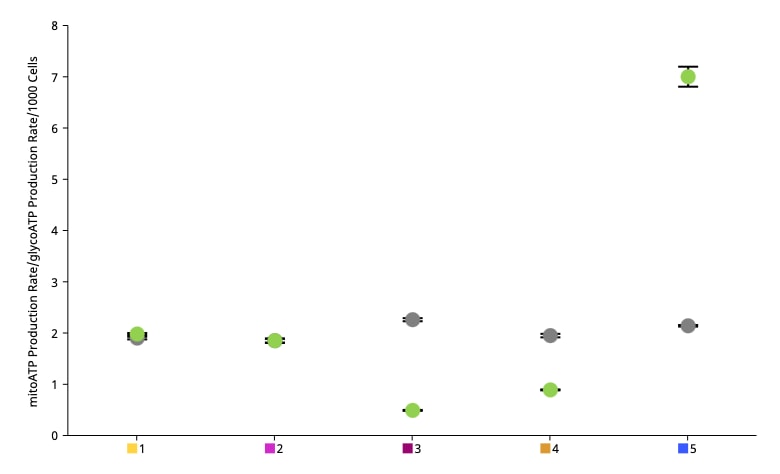
- Add Widget > XF ATP Rate Assay » XF ATP Rate Index(添加小组件 > XF ATP 速率测定 » XF ATP 速率指数):当前可在 XF ATP 速率测定小组件列表中找到 XF ATP 速率指数。XF ATP 速率指数小组件以空心圆标记绘制基础线粒体呼吸 ATP 产生速率与基础糖酵解 ATP 产生速率的比值,并以实心圆标记绘制每组的诱导线粒体呼吸 ATP 产生速率平均值与诱导糖酵解 ATP 产生速率平均值的比值(仅当应用于诱导分析结果文件时 — 下图所示小组件显示了诱导 XF ATP 速率测定的数据)。另请注意,必须为检测液、背景孔和实验组分配正确的缓冲系数,然后才能计算该小组件数据。
5.5 导出和共享数据
5.5 导出和共享数据
将您的数据导出为 Microsoft Excel 或 GraphPad Prism 文件,或使用 Seahorse Analytics 与合作者直接共享您的结果数据和见解。
数据导出:
有几种方法可以将 Seahorse Analytics 中的数据导出为 Microsoft Excel、GraphPad Prism 或图像文件。
导出所有速率数据
可以创建包含所选文件的所有速率数据的 Excel 和 Prism 文件。该导出不包括已在分析视图中计算的任何参数计算值(如备用呼吸能力),您将需要从各小组件单独导出这些数据。
如何导出所有速率数据:
- 前往 Files(文件)或 Home(主页)视图。
- 点击文件列右侧所示的 3 个点以显示菜单。
- 点击 Export to Excel(导出到 Excel)或 Export to Prism(导出到 Prism)以创建所需文件。
- 使用主页和文件视图中单个文件菜单下的 Export to Excel(导出到 Excel)和 Export to Prism(导出到 Prism)选项(绿色高亮,右图)。
如何使用该导出功能?这种类型的数据导出使用户能够轻松地将所有速率数据(OCR、ECAR 和 PER 数据)传输到 Prism 或 Excel 中,以创建高质量或自定义数据图、执行统计分析以及 Seahorse Analytics 未提供的其他分析功能。
从各个小组件导出选定的数据:您可以将选定的各个小组件中的数据导出到 Excel 和 Prism 文件中。导出文件中的数据将完全按照小组件中设置的格式显示。例如,如果将小组件配置为在 well(孔)模式下显示基础呼吸,则 Prism 导出文件将包含各组各个孔的基础呼吸数据。如果将小组件配置为在 group(组)模式下显示基础呼吸,则 Prism 导出文件将显示组平均值和误差值,而不是单个孔的数值。
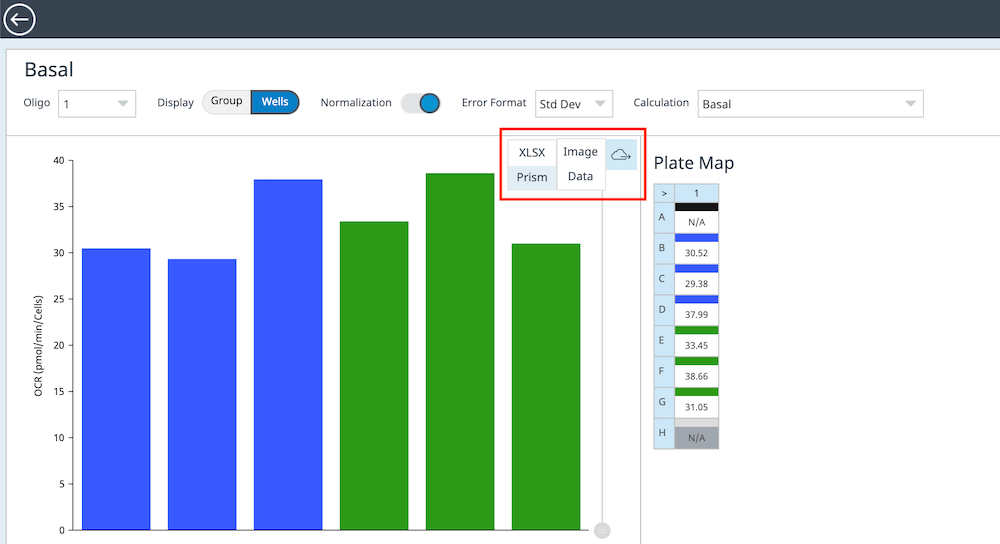
如何导出所有速率数据:
- 在任意分析视图或小组件编辑器视图中,找到小组件右上角的小云朵按钮。
- 将鼠标移动到云朵按钮上可显示 Image(图像)和 Data(数据)导出选项。
- 将光标滑动到 Image(图像)上方以将小组件导出为 PNG 或 JPG 文件,或滑动到 Data(数据)以将小组件导出为 Excel 或 Prism 文件。
- 导出文件中的数据将完全按照小组件中设置的格式显示。在此示例中,Prism 导出文件包含孔板上两个组的每孔基础呼吸值。

如何使用该导出功能?此类型的数据导出使用户能够将所选速率或参数数据轻松导出为图像文件,或者导出为 Prism 或 Excel 文件。Prism 和 Excel 导出使您可以准确获取想要进一步分析的数据(例如用于创建高质量或自定义数据图、执行统计分析以及 Seahorse Analytics 未提供的其他分析功能),而不是导出所有数据,然后再尝试找到所需要的具体信息。
文件共享:
您可以使用内置的文件共享功能与合作者或您的团队共享各个分析结果文件。共享功能位于主页和文件视图上每个分析结果文件右侧的 3 点式菜单下(右图)。
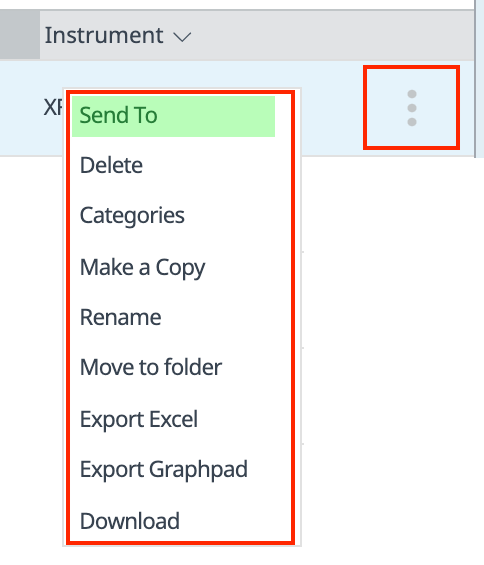
点击 Send to(发送至)将显示一个对话框,输入收件人的电子邮件地址,然后点击 Send(发送)以发送您的数据文件。如果收件人没有 Seahorse Analytics 账户,他们必须创建一个账户才能查看数据文件。如果收件人有账户,他们将收到一封电子邮件,通知他们收到了一份共享文件。他们也将在 Seahorse Analytics(右上角的铃铛图标)中看到一则通知,他们将在此接受(或拒绝)该共享文件。
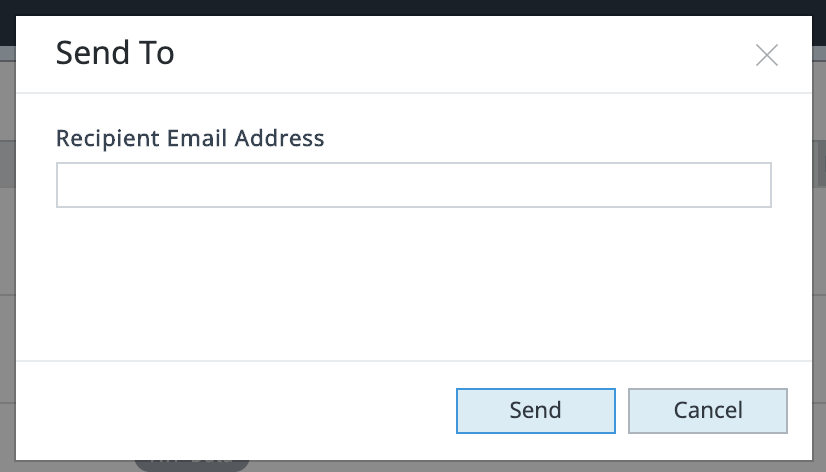
如何使用该共享功能?共享功能允许您直接通过应用程序向具有或不具有 Seahorse Analytics 账户的人发送分析结果文件。您选择共享的分析结果文件将在收件人的账户中创建一个该数据文件的副本,小组件布局、选择和分析视图与共享文件之前您设置的格式完全相同。收件人可以对共享文件进行修改,但您这边的文件将保持不变。
将您的数据导出为 Microsoft Excel 或 GraphPad Prism 文件,或使用 Seahorse Analytics 与合作者直接共享您的结果数据和见解。
从分析视图导出数据:
- 单击 Export View(导出视图)。
- 选择所需的导出文件类型。
从文件视图导出数据:
- 使用文件名旁边的复选框选择所需的文件。
- 单击 Export(导出)按钮。
- 选择所需的导出文件类型。
从文件视图共享文件:
- 使用文件名旁边的复选框选择所需的文件。
- 单击 Send To(发送至)按钮。
- 输入收件人电子邮件地址并可选择添加说明信息,然后单击 Send(发送)。
注意:如果收件人没有 Seahorse Analytics 账户,必须创建一个账户才能查看数据文件。
相关支持材料
参考资料

仅显示 Seahorse Seahorse XF Pro 的信息
更改仪器类型这一部分重点介绍了使用 Wave Desktop 和报告生成器软件查看并分析检测结果数据。如需显示 Seahorse Analytics 的帮助内容,请点击此处。
Wave Desktop 是用于任意 XF、XFe 和 XFp 分析仪生成的结果文件的数据分析软件。使用 Wave Desktop 的灵活分析视图、内置报告工具和其他强大的分析功能,可以将复杂的细胞代谢数据转化为可发布的结果。
XF 报告生成器是 Microsoft Excel 宏文件,可自动计算每个 Seahorse XF 检测试剂盒的参数,并将结果数据呈现在一页纸的定制总结报告中。
选择以下主题了解更多信息:
5.1 电脑性能指标与兼容性
Wave Desktop 是一款适用于所有 Seahorse 分析仪的实验设计和数据分析软件,支持:
- 对所有 Seahorse 分析仪(XFe96、XFe24、XFp、XF96 和 XF24)的数据文件进行分析。
- 为 XFe96、XFe24 和 XFp 分析仪创建并定制检测模板。
- 将数据导出至 (1) Microsoft Excel、(2) GraphPad Prism 或 (3) XF 报告生成器。
- 支持 Windows 和 Macintosh 电脑的 Microsoft Excel(32 位和 64 位)。
建议更新到 Wave Desktop 软件最新版本。Wave Desktop 软件的最新版本是 2.6.1 版(2019 年 4 月)。Wave Desktop 软件可安装在采用 Windows 7 或更高版本操作系统的任意电脑上。
以下是 Wave Desktop 2.6 软件的电脑性能指标和兼容性详情:
| 计算机 | 性能指标 |
|---|---|
| Windows PC | 操作系统:Windows 7、8.1 和 10 |
| 处理器:Intel Core i3(或更高配置) | |
| 硬盘空间:175 GB | |
| 系统内存 (RAM):4 GB(最小*) | |
| 屏幕分辨率:1280 × 800(最小) | |
| 支持的 Excel 版本:2010、2013 和 2016 | |
| Macintosh 电脑(需要使用虚拟机) | 操作系统:Mac OSx 10.11 或更高 |
| 虚拟机:Parallels 12 与 Windows 7、8.1、10 | |
| 处理器:Intel Core i3(或更高配置) | |
| 硬盘空间:175 GB | |
| 系统内存 (RAM):4 GB(最小*) | |
| 屏幕分辨率:1280 × 800(最小) | |
| 支持的 Excel 版本:2011 和 2016 |
* 推荐使用 8 GB(或更大)系统内存 (RAM),以获得更出色的软件体验。
相关支持材料
参考资料
5.2 数据类型
细胞耗氧量(呼吸)和质子分泌(糖酵解)导致溶解氧和游离质子的浓度发生快速且易测量的变化。安捷伦 Seahorse XF 分析仪可通过分离微孔板中单层细胞上极小体积(约 2 µL)的检测液,实时测量溶解氧和自由质子浓度,然后分别计算出 OCR 和 ECAR。
利用 Wave Desktop 软件,您可以轻松获得并查看以下数据:
XF 分析仪的主要输出是速率数据。
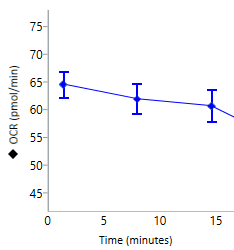
耗氧率 (OCR):每孔耗氧量的定量测量值,是线粒体呼吸的一个指标,以皮摩尔/分钟 (pmol/min) vs 时间进行报告。
在 Rate(速率)模式下显示的耗氧率 (OCR) 数据(右)
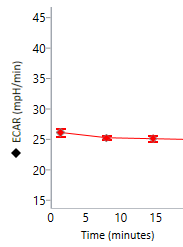
细胞外酸化率 (ECAR):细胞外检测液中质子释放的定性测量值,以 pH 千分之一/分钟 (mpH/min) vs 时间进行报告。
在 Rate(速率)模式下显示的细胞外酸化率 (ECAR) 数据(右)
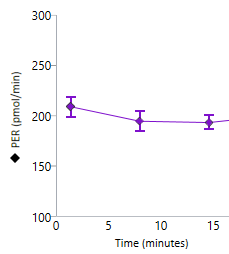
质子释放率 (PER):细胞外酸化程度的定量指标,考虑了检测液缓冲能力和孔板几何形状。以皮摩尔/分钟 (pmol/min) vs 时间进行报告。只能在运行后的实验结果分析中获得,在分析运行期间无法获得 PER。
参阅 Wave 用户指南第 3 章,了解关于 Wave 软件可用数据类型的更多信息。
水平数据用于计算速率数据,也可用于诊断目的。
氧浓度 (mmHg):细胞(或其他生物材料)在测量过程中会消耗氧气,导致氧张力降低。这种氧张力的降低可用于计算耗氧率 (OCR)。您可以利用 Y1 下拉菜单中的概览分析视图查看氧张力水平数据。
Level(水平)模式下以 mmHg 相对时间变化显示的氧张力 (O2) 数据(右)
质子浓度 (mpH):细胞(或其他生物材料)在测量过程中会产生质子,导致质子浓度增加。测量整个 XF 分析过程中微室内的游离质子浓度,并作为细胞外酸化率 (ECAR) 进行计算。您可以使用 Y1 下拉菜单中的“概览”分析视图查看 mpH 水平数据。
在 Level(水平)模式下显示的质子浓度 (mpH) 数据(右)
相关支持材料
参考资料
5.3 数据显示选项
Wave 提供了一组用于查看并解析实验结果数据的标准图形选项。Wave 可根据所选的分析视图类型自动计算,并将结果数据以如下方式图形化:
动力学曲线
动力学曲线是显示 XF 分析仪速率数据最常用的一种方法。动力学曲线的 y 轴表示速率,x 轴表示时间。在分析过程中,采集的数据将实时绘制成动力学曲线。动力学曲线可以在 Wave 软件的快速视图和概览分析视图中找到。
能量图
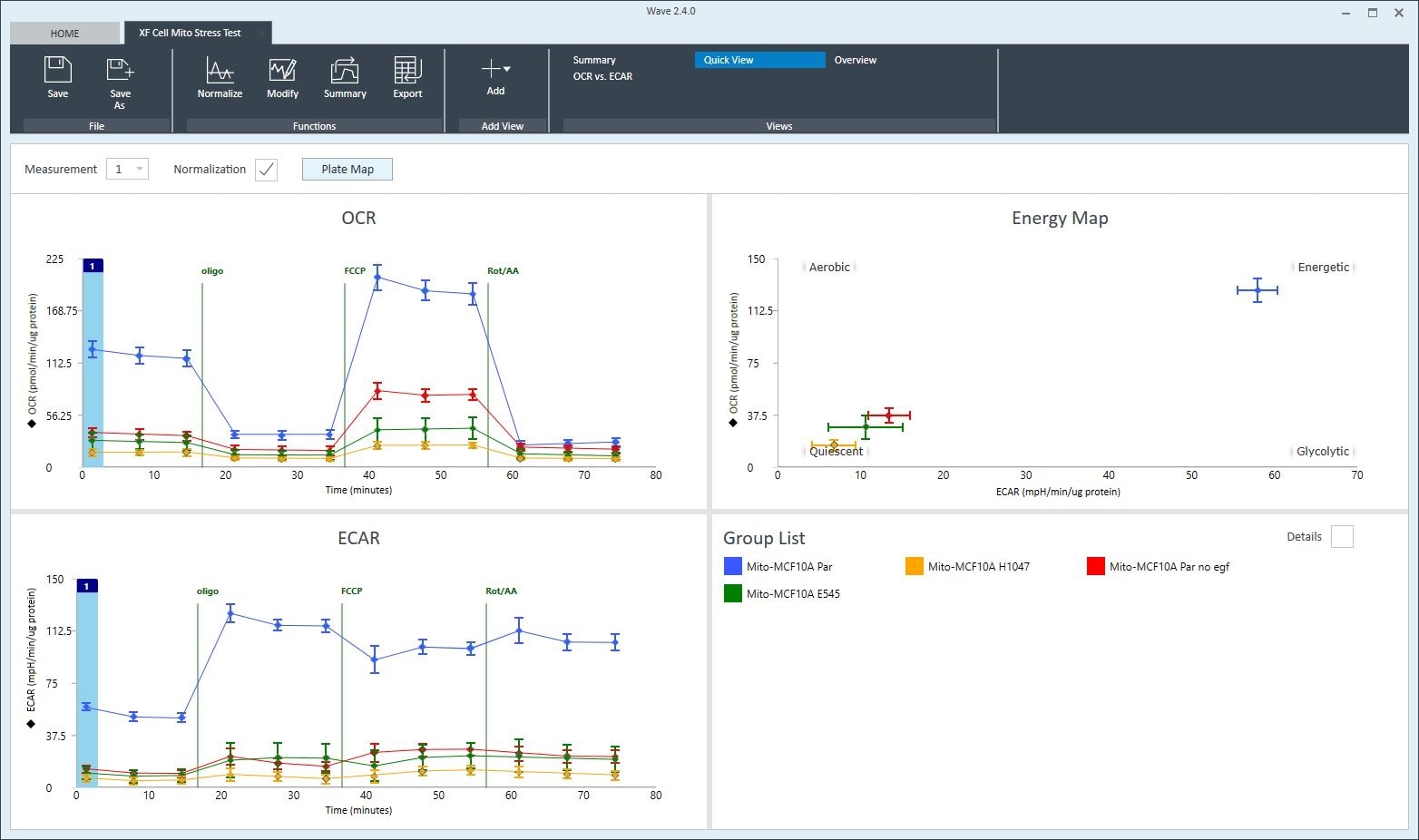
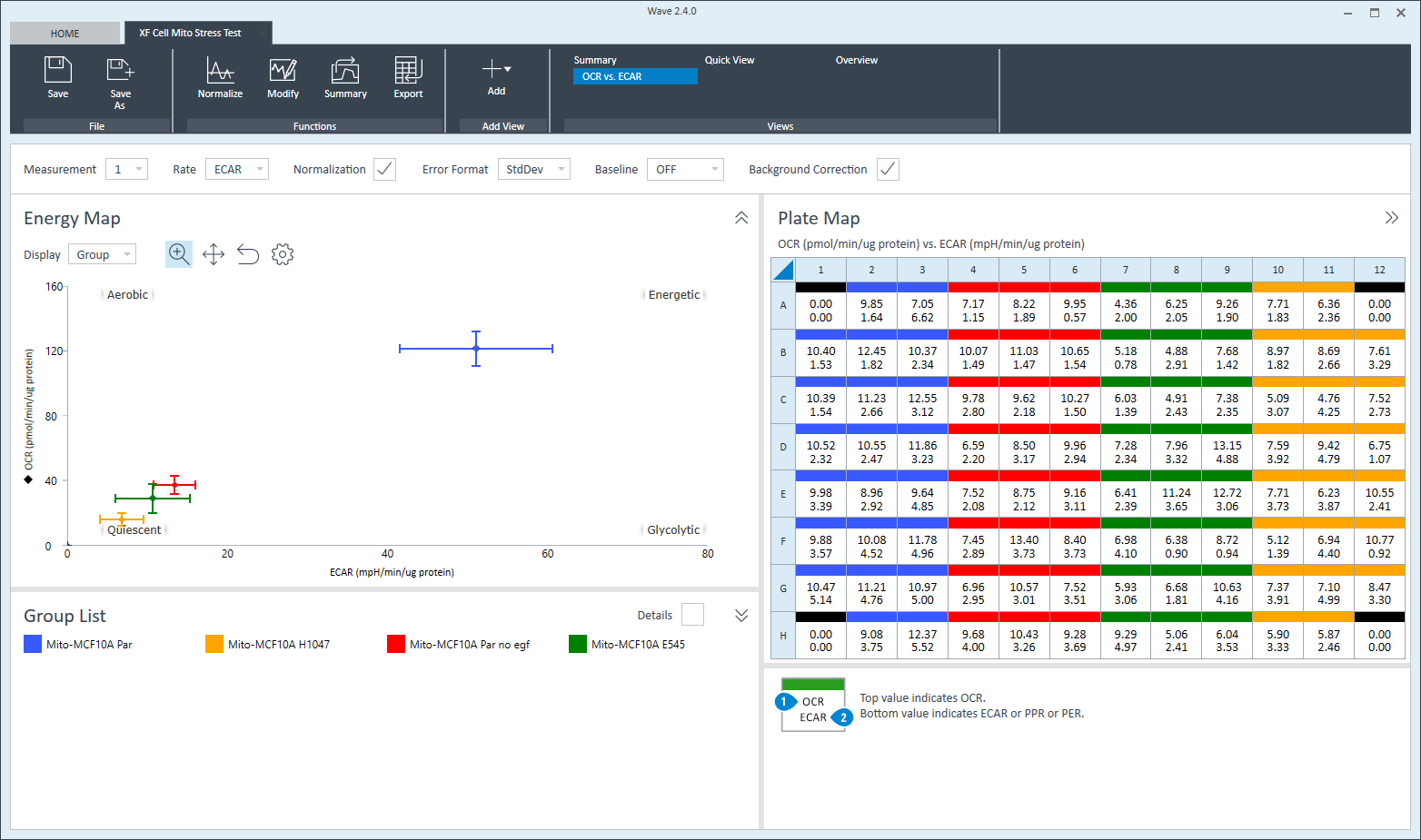
另一种绘制 XF 结果数据的常见方法是能量图(散点图),其中 y 轴通常表示耗氧量 (OCR),x 轴常表示酸化数据(ECAR 或 PER)。使用“测量”下拉菜单选择速率测量值,以显示每组的能量图。使用“速率”下拉菜单将 x 轴的速率改为 PER。可以在快速视图和 OCR 与 ECAR 分析视图中找到能量图图形选项。
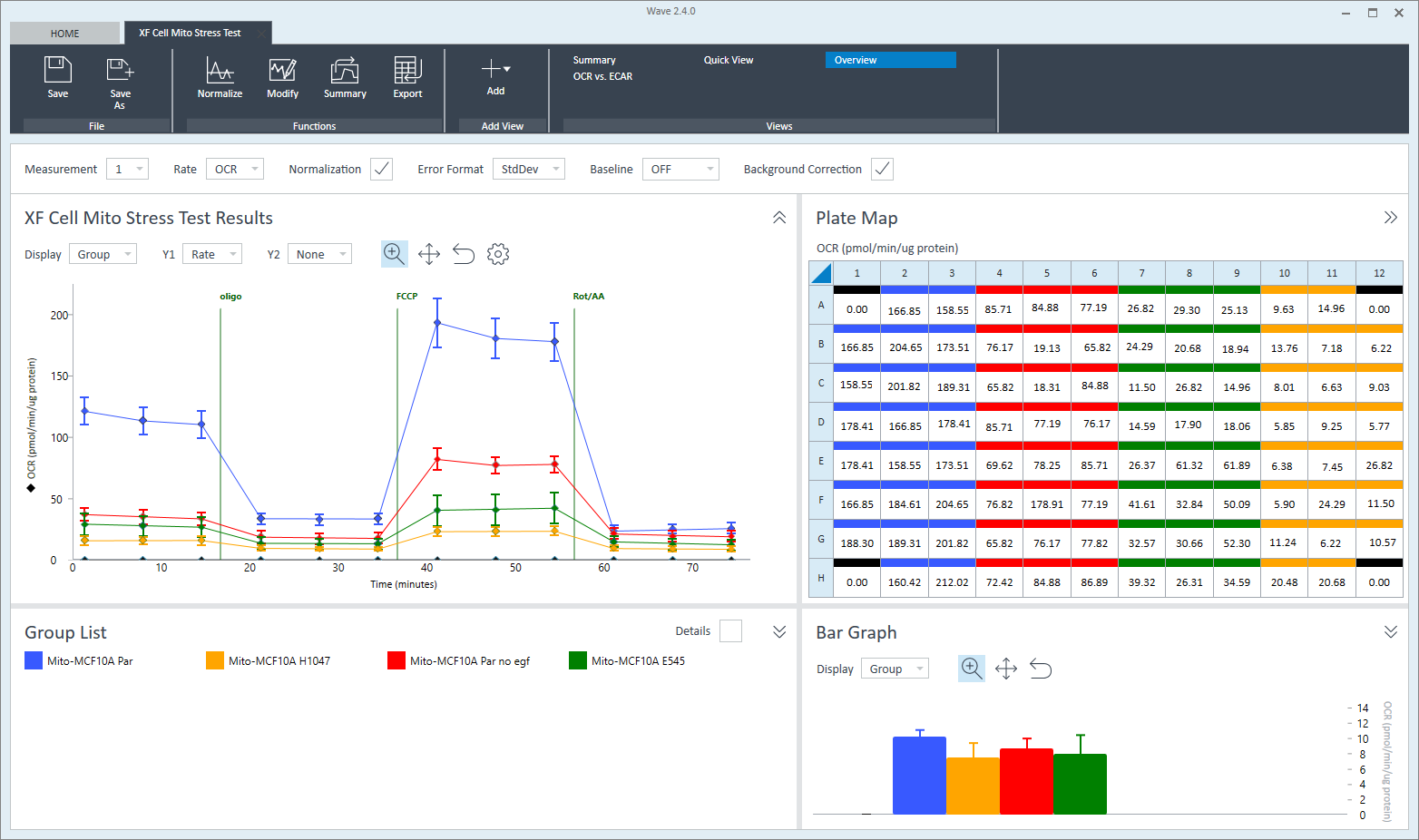
板布局
板布局很好地显示了每个实验孔选定速率测量的速率数据。在分析过程中,板布局通常显示在 Wave 的右上角,也可在快速视图、概览以及 OCR 与 ECAR 分析视图中找到。快速视图中有一个显示板布局的按钮,默认为隐藏状态。
Quick View(快速视图)和 OCR vs. ECAR(OCR 与 ECAR)分析视图中的板布局显示了两种速率:耗氧率(OCR — 顶部)和酸化数据(ECAR 或 PER — 底部)。Overview(概览)分析视图中的板布局显示了一种速率 — OCR、ECAR 或 PER。
打开一个新的分析视图时,板布局默认显示速率测量 1 的数据。在分析过程中,可使用“速率”下拉菜单显示另一个速率测量的数据。
条形图
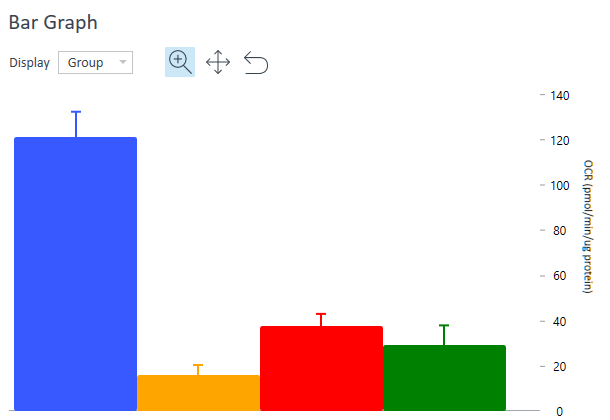
Bar Graph(条形图)仅在概览分析视图(板布局下方)中可见,显示的是所选测量的每组平均速率。使用 Display(显示)下拉菜单将速率显示从组(平均)变为孔(单个孔)模式。
条形图可用于确定异常值、最佳 FCCP 浓度、最佳细胞接种密度,或在测量数据绘制成动力学曲线或散点图时可能不明显的其他趋势。
组列表
组列表是动力学曲线或散点图中绘制数据的图例。

使用组列表可以:
- 双击组名隐藏或显示各组的数据图。
- 勾选组列表右上角的 Details(详情)框可显示组统计数据。统计数据显示为所选速率测量的平均值和误差。选择不同的速率测量可显示该速率的组统计数据。
- 板布局中关闭的实验孔不包括在计算的组统计数据中。
- 隐藏某个组时,该组的平均值和标准偏差为:平均值 0.00;标准偏差 0:00。
参阅 Wave 用户指南第 3 章,了解关于 Wave 软件可用数据类型的更多信息。
相关支持材料
参考资料
5.4 分析视图
4 个可定制的分析视图可添加到 Wave Desktop 的分析结果文件中。使用顶层功能区菜单中的 Add View(添加视图)按钮,将每个分析视图多次添加到一个分析结果文件中。
快速视图
Quick View(快速视图)是打开一个新的分析结果文件时显示的默认分析视图。快速视图同时显示 OCR 与时间的动力学曲线、ECAR 与时间的动力学曲线,以及 OCR 与 ECAR 的能量图。
概述
Overview(概览)显示速率(OCR、ECAR、PER 或 PPR)与时间的动力学曲线。y 轴显示所选速率,x 轴显示时间。勾选动力学曲线图下 Group List(组列表)中的 Details(详情)框可显示每个测量的组统计数据(平均速率与误差)。概览是 Wave 软件中用于常规分析功能最通用的分析视图。如需显示概览,点击 Add View(添加视图)并从视图列表中选择 Overview(概览)。
技巧:重复 Add View > Overview(添加视图 > 概览)过程可添加多个“概览”分析视图。这为自定义结果数据呈现方式,以显示特定组、响应或组之间的对比提供了更大的灵活性。
OCR 与 ECAR
OCR vs. ECAR(OCR 与 ECAR)视图显示了一个能量图,其中 y 轴为 OCR(默认),x 轴为 ECAR。利用“速率”下拉菜单可将 x 轴显示的速率更改为 PER 或 PPR。y 轴通常显示 OCR,无法修改。如需显示 OCR 与 ECAR,点击 Add View(添加视图)并从视图列表中选择 OCR vs. ECAR(OCR 与 ECAR)。
数据
Data(数据)视图包含与分析结果文件相关的所有数据,分为 7 个选项卡:
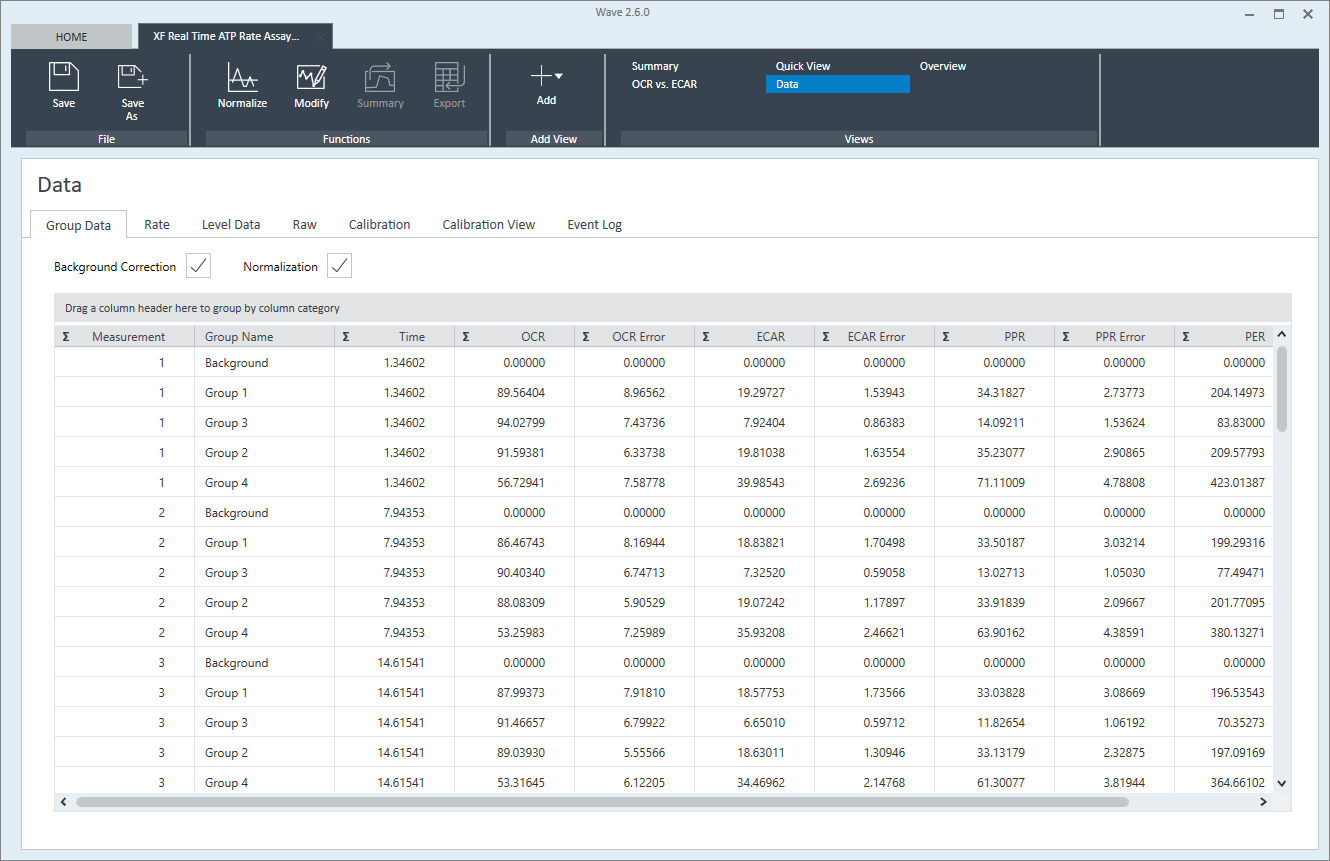
- Group Data(组数据):每组的平均速率数据(OCR、ECAR、PER 或 PPR)和误差,按测量编号排序。
- Rate(速率):按测量编号排序的单孔速率数据(OCR、ECAR、PER 或 PPR)。不显示误差值。
- Level Data(水平数据):按测量编号排序的各个孔的水平数据(O2 和 pH)。
- Raw(原始数据):原始测量数据,包括每次测量记录的 O2 和 pH 光发射值、参考值、孔和环境温度。该选项卡最常用于技术支持,而非常规数据分析。
- Calibration(校准):每孔的 O2 和 pH 校准结果。
- Calibration View(校准视图):每个实验孔的 O2 和 pH 校准结果,显示为板布局。
- Event Log(事件日志):分析仪序列号、软件版本、板与条码批号等分析信息以及分析期间的其他设置。还提供了 XF 分析时使用的方案命令可排序表格,包括命令名称、时间和结果。
如需显示数据视图,点击 Add View(添加视图)并从视图列表中选择 Data(数据)。打开数据视图时,默认显示组数据选项卡。
参阅 Wave 用户指南第 3 章,获取关于每个分析视图的详细信息,包括将数据重新计算为基线百分比、将速率数据归一化为生物学参数(即细胞数量)、在板布局上标记实验孔,以及其他关键分析功能和特征。
相关支持材料
参考资料
5.5 XF 报告生成器
安捷伦 Seahorse XF 报告生成器是 Microsoft Excel 宏文件,可自动计算每个 Seahorse XF 检测试剂盒的参数,并将结果数据呈现在一页纸的定制总结报告中。
Wave 可一键式直接将结果数据导出至 XF 报告生成器,Wave 中对结果数据的任意修改(如排除的实验孔或归一化速率数据)都将包含在导出和分析的报告生成器 Excel 文件中。单击顶层功能区菜单中的 Export(导出)选项,可显示可用的 XF 报告生成器导出选项列表。
为何使用 XF 报告生成器?
- 更高效、更一致的数据分析 — 将原始动力学数据转化为可解析的结果,避免重复的手动计算和数据处理。
- 几秒内总结出 XF 结果数据 — 以有序、可定制、易于理解的报告形式呈现数据。
- 可扩展以满足您的分析需求 — 使用多文件 XF 报告生成器一次性导入并分析最多 5 个重复结果文件。
- 协作更简单 — 无需任何特殊软件程序或许可,即可查看并重新分析报告生成器中的结果数据。
- 支持以下分析:
- 在 Seahorse XFe、XF 和 XFp 分析仪上生成的数据文件。
- Windows 电脑上的 Microsoft Excel 2010、2013 和 2016。
- Apple 计算机上的 Mac 2011 和 2016 Excel。
| XF 报告生成器 — 下载页面 | 单文件分析 | 多文件分析 |
|---|---|---|
| Seahorse XF 细胞能量代谢表型测试 | 单文件用户指南 | 多文件用户指南 |
| Seahorse XF 细胞线粒体压力测试 | 单文件用户指南 | 多文件用户指南 |
| Seahorse XF 实时 ATP 速率测定 | 单文件用户指南 | 不适用 |
| Seahorse XF 糖酵解速率测定 | 单文件用户指南 | 多文件用户指南 |
| Seahorse XF 线粒体底物分析 | 单文件用户指南 | 不适用 |
| Seahorse XF 糖酵解压力测试 | 单文件用户指南 | 不适用 |
相关支持材料
参考资料

仅显示 Seahorse Seahorse XF Pro 的信息
更改仪器类型6. 更多信息
XF 学习中心的这一部分将介绍关于 XF 分析仪使用的各种主题,包括一系列 XF 检测试剂盒及应用,其他分析条件和样品类型,以及 XF 数据的归一化和分析。
选择以下主题了解更多信息:
6.1 XF 分析与应用
安捷伦 XF 检测试剂盒和试剂专用于 XF 分析仪,可确保结果的可靠性和一致性。Seahorse XF 试剂盒和试剂通过提供预校准、预测试过的试剂,来简化 XF 分析的运行,用于测定有价值的功能代谢参数,包括细胞 ATP 产生速率、线粒体功能、糖酵解活性,以及活细胞、透化细胞和分离的线粒体中的底物氧化。
注:所有 XFp 检测试剂盒和消耗品均与 XF HS Mini 分析仪兼容。
以下材料提供了进行各种 XF 分析的信息和方法。
细胞 ATP 产生
线粒体功能
- 概述:采用安捷伦 Seahorse XF 细胞线粒体压力测试测定线粒体呼吸作用
- 试剂盒信息:XF 细胞线粒体压力测试试剂盒
- 试剂盒信息:XF 细胞线粒体压力测试试剂盒
- 出版物:Analysis and Interpretation of Microplate-Based Oxygen Consumption and pH Data (Divakaruni, et al, Methods in Enzymology, 2014)
- 出版物:Assessing bioenergetic function in response to oxidative stress by metabolic profiling (Dranka, et al, Free Radic Biol Med, 2011)
线粒体底物氧化
免疫细胞活化检测
免疫细胞检测
- 试剂盒信息:安捷伦 Seahorse T 细胞和 NK 细胞代谢分析检测
- 网络研讨会:T 细胞疗法 XF Pro 解决方案 | 安捷伦
- 视频:代谢分析指标:T 细胞疗法的关键驱动因素
- 应用简报:利用实时细胞能量代谢分析评估 T 细胞的生物能量代谢平衡和备用呼吸能力
- 应用简报:利用实时细胞能量代谢分析评估 NK 细胞的生物能量代谢
- 概述:在几分钟内完成免疫细胞活化测定
- 试剂盒信息:XF Hu T 细胞活化测定试剂盒
- 试剂盒信息:XF Hu T 细胞活化测定试剂盒
- 网络研讨会:如何分析 XF 中性粒细胞活化结果数据
- 应用简报:实时检测和调节 T 细胞活化
- 应用简报:一种评估 T 细胞活化的新方法
- 应用简报:实时检测和调节 T 细胞活化
- 应用简报:实时监测巨噬细胞对活化的响应
- 应用简报:一种评估中性粒细胞活化和氧化迸发的新方法
线粒体毒性
6.2 XF 数据的归一化
无论是比较不同的细胞类型、遗传修饰还是化合物处理,功能生物学数据的归一化都是执行 XF 分析和/或随后的 XF 数据分析和解析工作流程中的关键组成部分。XF 分析的归一化可以应用于几种水平,包括细胞数、基因组 DNA 和总细胞蛋白。
以下材料为您提供了 XF 数据归一化方法的信息。
- 概述:XF 数据归一化概述
- 概述:XF 贴壁细胞数据归一化概述
- 网络研讨会:使用自动细胞计数实现 Seahorse XF 数据归一化
- 技术指南:Seahorse XF 成像和归一化系统 — XFe96 Hoechst33342 染色优化指南
- 技术指南:Seahorse XF 贴壁细胞成像和归一化系统 — XFe96 Hoechst33342 染色优化指南
- 技术指南:Seahorse XF 成像和归一化系统 — XFe24 Hoechst33342 染色优化指南
- 技术简报:使用明场图像与 Seahorse XF 成像和归一化系统进行数据质量管理
- 技术简报:归一化 XF 代谢数据至细胞参数的方法和策略
- 应用简报:在安捷伦 Seahorse XF 实验中使用 Agilent NovoCyte 流式细胞仪进行免疫细胞悬液归一化
6.2 脂肪酸氧化实验
代谢途径和能量消耗的调节以及底物氧化差异如何促成代谢调节的信号转导机制对于诸如免疫学、癌症和干细胞生物学以及药物靶标识别和作用机制研究等各种领域的研究人员来说是一个重要的课题。
6.3 透化细胞和分离的线粒体
线粒体功能研究是临床和基础科学研究的核心。安捷伦 Seahorse XF 细胞线粒体压力测试可提供初始线粒体生物能量代谢谱。然而,对驱动所观察到的变化的特定酶或途径进行检测可以提供其他信息以及疾病状态下代谢酶针对该疾病状态的相关变化。
研究底物氧化的传统方法涉及线粒体的分离,XF 分析仪支持高通量分析,对于机理研究,其能量需求和底物可用性都可以使用更少量的分离线粒体进行严格控制。
然而,在分离线粒体时存在一些缺点,包括数量有限和源于分离期间线粒体的亚选择或损伤带来的偏差。XF 细胞膜通透剂 (PMP) 在贴壁细胞的质膜中形成孔,而不会对线粒体膜造成任何伴随性损伤。该试剂通过完整细胞克服了与使用分离的线粒体或底物补充培养基相关的挑战。
线粒体功能研究是临床和基础科学研究的核心。利用完整细胞进行线粒体呼吸测量有助于更准确的了解代谢过程及代谢失调,从而为癌症、免疫学和线粒体毒理学等研究领域提供重要支持。
将完整细胞与安捷伦 Seahorse XF 检测技术相结合,可以获得细胞的整体生物能量代谢谱以及线粒体生物能量代谢谱。然而,由于线粒体功能可能随着线粒体底物氧化情况的变化而发生变化,因此可以通过检测完整细胞中特定底物的氧化情况来了解线粒体活性差异背后的机制。
XF 细胞膜通透剂 (XF PMP) 可实现安全、稳定的原位细胞膜透化,从而准确控制实验过程中的线粒体底物供应,而无需从培养细胞中分离线粒体或使用去垢剂(毛地黄皂苷)进行细胞透化处理。这样一来,研究人员能够在单次实验中评估多种线粒体底物氧化通路,从而直接对 CI、CII 和 CIV 关联呼吸进行功能性测量
XF Electron Flow 检测技术通过结合 XF PMP、底物和抑制剂,为了解线粒体功能提供了一种强大的方法,可用于测试干预措施(遗传操控/化合物处理)对线粒体的影响。
因此,在具备相关细胞模型(包括已建立的细胞系和原代细胞)的情况下,采用 XF PMP 进行原位细胞膜透化远比从培养细胞中分离出线粒体进行研究更具优势(见下表)。
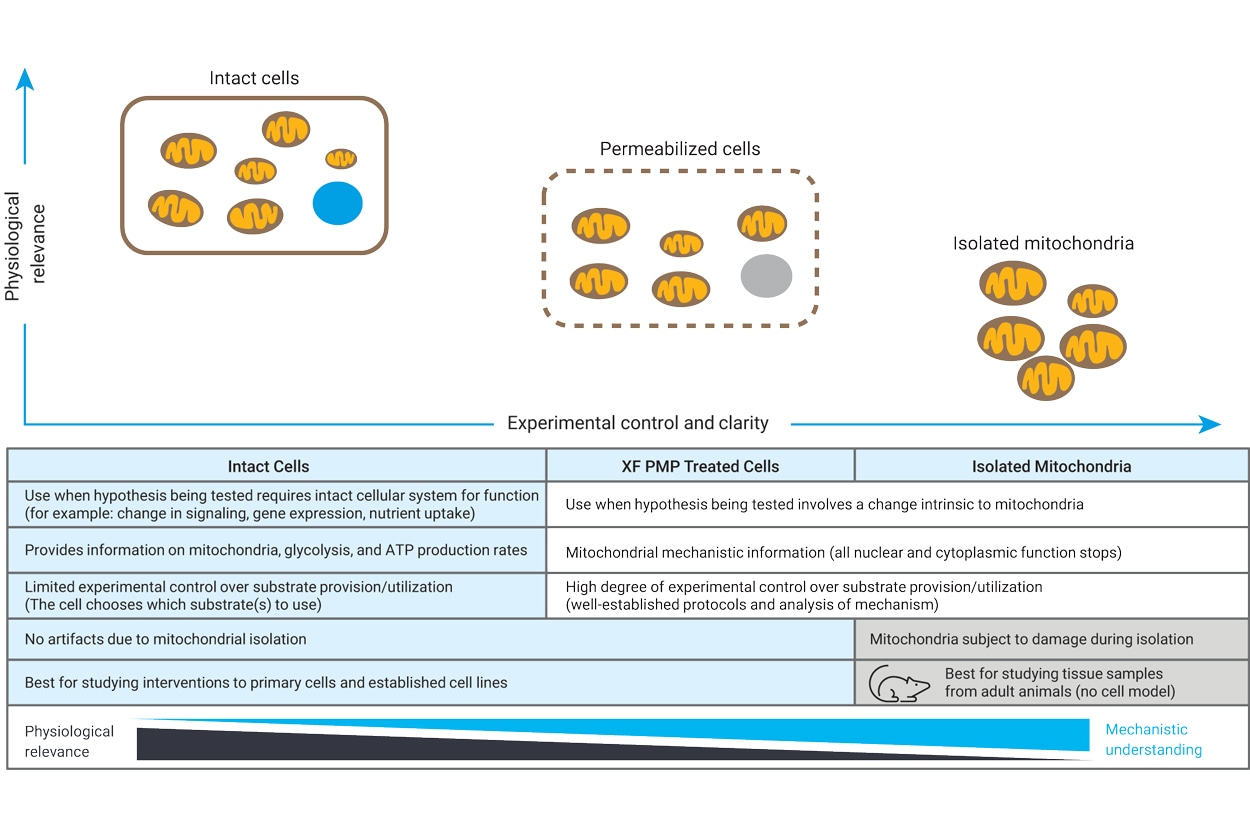
下文阐述了如何通过 XF PMP 细胞透化处理与 XF Electron Flow 检测技术研究化合物处理和/或遗传操控造成的线粒体功能变化。
透化细胞
- 概述:XF 细胞膜通透试剂
- 技术简报:采用以 XF 细胞膜通透剂 (PMP) 透化的细胞评估线粒体呼吸链膜蛋白复合体
- 技术简报:使用 PMP 测定透化细胞中底物特异性 ETC/OxPhos 活性
- 技术简报:使用 PMP 测定有限生物材料中的线粒体 ETC 复合物活性
- 概述:XF 细胞膜通透剂
- 试剂信息:XF 细胞膜通透剂
- 技术概述:使用安捷伦 Seahorse XF 细胞膜通透剂进行 XF Electron Flow 检测
- 应用简报:应用安捷伦 Seahorse XF 细胞膜通透剂和 XF Electron Flow 检测 — 数据分析与解读
- 出版物:Measuring Mitochondrial Function in Permeabilized Cells Using the Seahorse XF Analyzer or a Clark-Type Oxygen Electrode (Divakaruni, et al, Curr Protoc Toxicol, 2014)
- 出版物:Thiazolidinediones are acute, specific inhibitors of the mitochondrial pyruvate carrier (Divakaruni, et al, PNAS, 2013)
分离的线粒体
- 应用简报:采用安捷伦 Seahorse XFe/XF96 分析仪分析微克级分离线粒体
- 应用简报:采用安捷伦 Seahorse XFe/XF24 分析仪分析微克级分离线粒体
- 出版物:High Throughput Microplate Respiratory Measurements Using Minimal Quantities Of Isolated Mitochondria (Rogers, et al, PLoS One, 2011)
- 出版物:Preparation and Respirometric Assessment of Mitochondria Isolated from Skeletal Muscle Tissue Obtained by Percutaneous Needle Biopsy (Bharadwaj et al, JOVE, 2015)
- 出版物:Isolation of Mitochondria from Minimal Quantities of Mouse Skeletal Muscle for High Throughput Microplate Respiratory Measurements (Boutagyet al, JOVE, 2015)
- 出版物:Using Isolated Mitochondria from Minimal Quantities of Mouse Skeletal Muscle for High throughput Microplate Respiratory Measurements (Boutagy, et al, JOVE, 2015)
6.4 缺氧和细胞球体
6.4 缺氧和胰岛
6.4 缺氧
分析仪能够在低氧环境(缺氧)下测定代谢,并支持对某些三维样品(包括细胞球体)的测定。
缺氧

仅显示 Seahorse Seahorse XF Pro 的信息
更改仪器类型需要了解更多信息?
通过在线商城购买用于 XF 分析的探针板、微孔板、试剂盒、培养基和试剂。浏览用于 XF 分析仪的 Seahorse 细胞分析消耗品产品的完整列表。
全球技术支持
全球/美国:
+1 719 528 7500
美国(免费热线):
+1 800 227 9770
欧洲(免费热线):
00 800 345 347 00
(英国、爱尔兰、法国、德国、丹麦或荷兰)
其他国家/地区:+45 8830 5500
中国(免费热线,座机):
800 820 3278
中国(免费热线,手机):
400 820 3278
