Integridade dos dados assegurada para qualificação de instrumento analítico

Minimize seus riscos em auditorias e inspeções regulatórias com os serviços de conformidade Agilent CrossLab
Laboratórios farmacêuticos — ou qualquer laboratório que produz resultados sujeitos a requisitos regulatórios — devem demonstrar e documentar a adequação de instrumentos analíticos ao uso a que se destinam. Os laboratórios podem lidar com esses requisitos realizando uma Qualificação de Instrumento Analítico (AIQ).
A Farmacopeia dos Estados Unidos é a única das principais farmacopeias com um capítulo inteiramente dedicado à AIQ: O <1058> da USP. Portanto, as alterações ao <1058> são de importância global. A versão 2017 do <1058> da USP entrou em vigor no dia 1º de agosto de 2017 — e é um documento regulatório importante com implicações significativas para seu laboratório.
A Agilent pode ajudá-lo a implantar um processo econômico de qualificação e a enquadrar seus procedimentos operacionais padrões (SOPs) para que atendam aos requisitos do <1058> da USP 2017 — dando à AIQ uma abordagem integrada com base no ciclo de vida.
O que você precisa saber sobre o <1058> da USP 2017
Abordagem de ciclo de vida da qualificação de instrumentos do <1058> da USP 2017:A melhor maneira de defender seu laboratório durante uma auditoria
Qualificação de Instrumentos — Abordagem de Ciclo de Vida
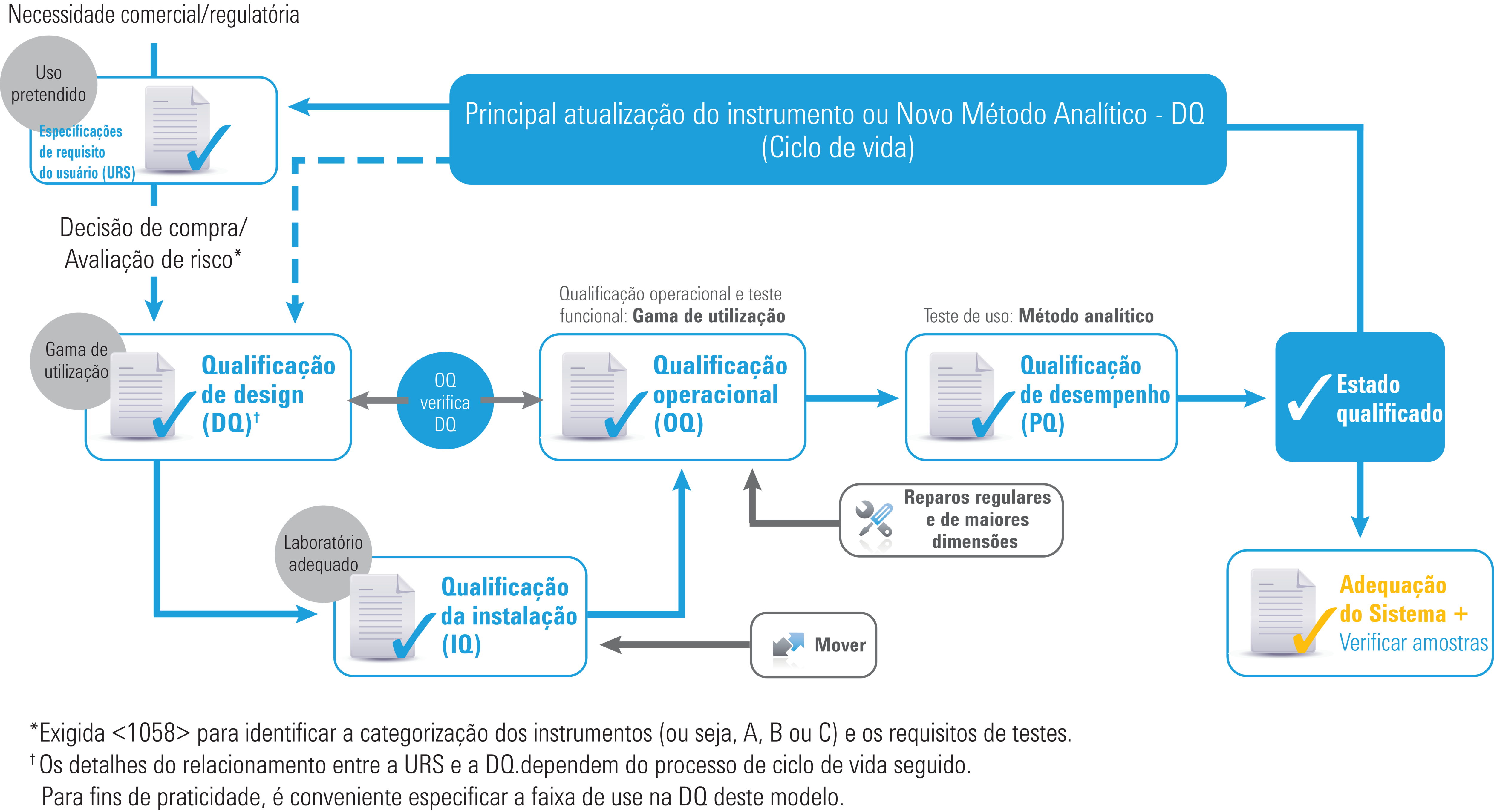
Ciclo de vida da qualificação do instrumento
O <1058> da USP 2017 revisado reflete como a AIQ evoluiu de modo a englobar todo o ciclo de vida do instrumento. Algumas diretrizes foram mantidas, como as seguintes:
- Instrumentos dos grupos A, B e C (embora os exemplos tenham sido removidos)
- Os “4Qs”: Qualificação de design (DQ), Qualificação da Instalação (IQ), Qualificação Operacional (OQ) e Qualificação de Desempenho (PQ)
No entanto, existem diferenças muito importantes que esclarecem as funções dos 4Qs, além da interação entre eles. Além disso, a seção referente a software foi consideravelmente ampliada.
Entre as alterações mais críticas estão:
- As especificações de requisito do usuário(URS) agora são exigidas
- Os testes de qualificação operacional (OQ) agora estão “amarrados” às URS/DQ
- A OQ (funcionalidade e amplitude de uso) agora é exigida
- A PQ (uso/aplicação pretendida) é agora exigida
- Agora DQ, OQ e PQ são dinamicamente alinhadas à utilização do instrumento
Isso significa que para o seu laboratório:
Políticas e procedimentos existentes associados ao ciclo de vida de seus instrumentos analíticos podem não atender na íntegra ao <1058> da USP 2017, e precisarão ser atualizados.
Os consultores de conformidade Agilent CrossLab podem ajudar seu laboratório a implantar processos de qualificação que já estão em conformidade com o <1058> da USP 2017.
Uma abordagem integrada entre a validação de software e a qualificação de instrumentos:Alinhamento do <1058> da USP a Boas Práticas de Fabricação Automatizada (GAMP)®
Qualificação contínua

* Os requisitos para se incluir uma matriz específica de rastreamento de requisitos no ciclo de vida da qualificação dependem da utilização pretendida, complexidade do instrumento, e que o GAMP da política da empresa seja uma marca comercial registrada da Associação Internacional de Engenharia Farmacêutica (ISPE). Consulte as publicações do GAMP no site da ISPE: www.ispe.org/publications/guidance-documents
Abordagem integrada da qualificação de hardware e validação de software
A expansão significativa de requisitos de software — combinada à remoção de exemplos de instrumentos dos grupos A, B e C — significa que o <1058> da USP agora se aproximou mais do GAMP® 5 em termos de conformidade.
Historicamente, o <1058> da USP tem simplificado o processo ao introduzir instrumentos dos grupos A e B em laboratórios regulamentados. A atualização de 2017 amplia esse benefício aos instrumentos do grupo C.
No entanto, os requisitos do <1058> da USP 2017 especificam uma avaliação de risco para identificar uma categoria para cada instrumento. Desta maneira, os laboratórios terão que justificar a classificação de seus instrumentos e atualizar seus procedimentos para definir de maneira consistente uma classificação com base na utilização do instrumento.
Juntas, essas alterações significam que o <1058> da USP 2017 pode agora ser considerado uma das alternativas de qualificação contínua em conformidade com o Guia de boas práticas do GAMP (GPG) para sistemas de laboratório computadorizados (ISBN 978-1-936379-49-1) e com o GAMP 5 (ISBN 1-931879-61-3). Especificamente:
- Utilize o <1058> da USP para instrumentos padrões (p. ex.: HPLC, GC)
- Utilize o GPG do GAMP para instrumentos complexos (p. ex.: QTOF)
- Utilize o GAMP 5 para validação do software personalizado
Isso significa que para o seu laboratório:
Para que seu laboratório atenda à conformidade, é necessário alinhar sua AIQ ao <1058> da USP 2017. Isso engloba todos os documentos da política de ciclo de vida de procedimentos operacionais padrões (SOPs) e da AIQ.
Os consultores de conformidade Agilent CrossLab estão disponíveis para ajudar a avaliar seus riscos de validação do sistema computacional (CSV) e a implantar/validar seus sistemas e software.
Governança de dados em laboratórios de análises:O fundamento de uma forte
integridade dos dados
Qualificação e integridade dos dados
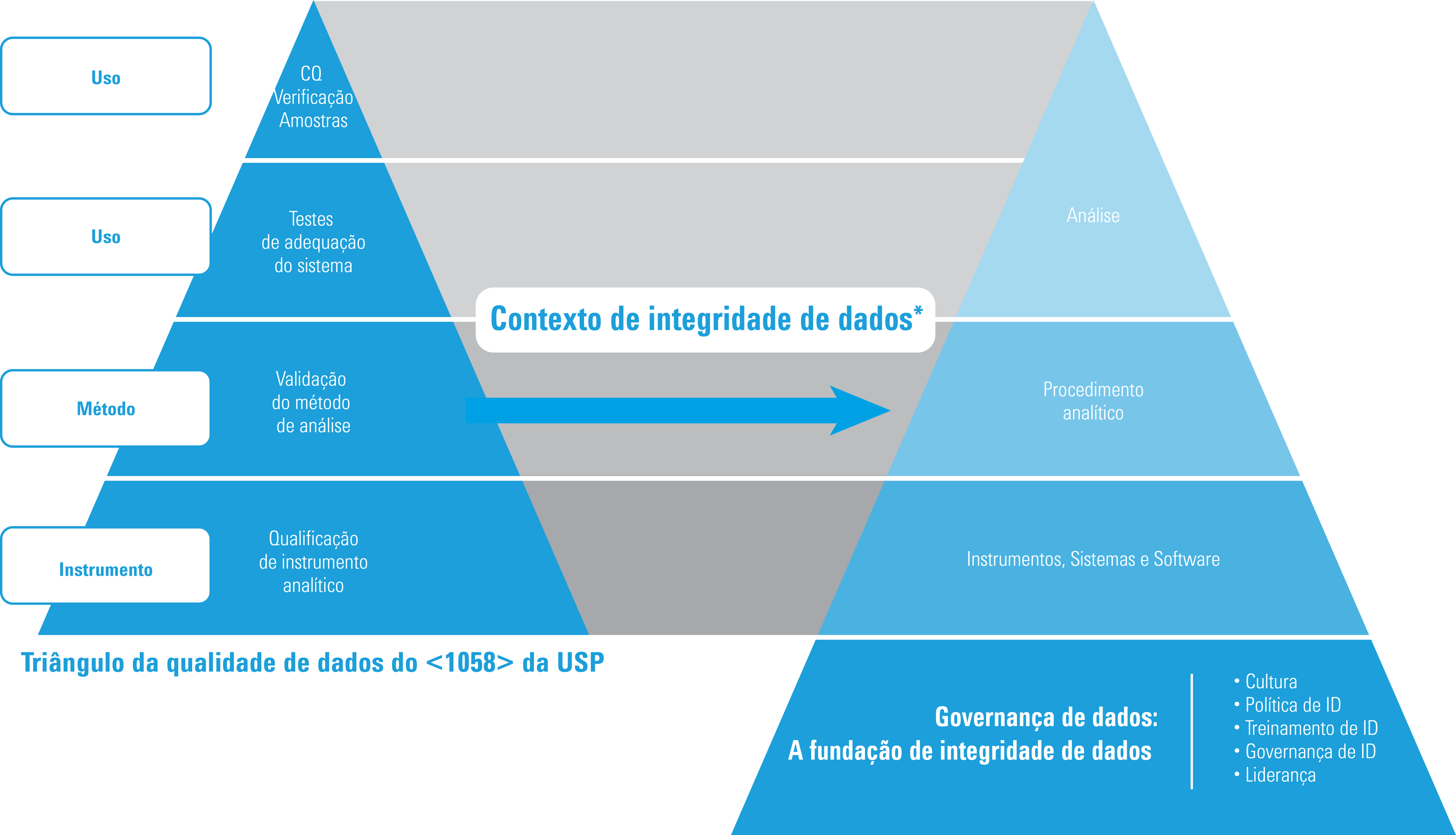
* Adaptação do ISBN 978-1-84973-662-6 mediante autorização
A importância da integridade dos dados
Resultados de auditorias regulatórias associados a violação de dados estão estimulando agências regulatórias ao redor do mundo a observar com mais atenção a integridade dos dados. Por algum tempo, isso significava que menos atenção era dada a áreas de foco da auditoria tradicional, como a AIQ. No entanto, o formulário 483 da FDA indica que os reguladores começaram uma vez mais a observar em detalhes a integridade dos dados, a rastreabilidade e o conteúdo técnico da AIQ.
O triângulo da qualidade de dados permanece inalterado no <1058> da USP 2017, mas, do ponto de vista da integridade dos dados, o triângulo evoluiu para o modelo aqui exibido. Em especial:
- A AIQ é a base do Triângulo da qualidade de dados do capítulo <1058> da USP
- Retrabalhos e retestes devem ser geridos e explicados (documentados).
- A Rastreabilidade de dados é agora um importante requisito
- A Governança de dados é agora a base de todos os dados de qualidade
Isso significa que para o seu laboratório:
Mais do que nunca, problemas de integridade dos dados gerarão ações regulatórias. Para defender com sucesso os seus resultados, você deve estar preparado para provar que os dados não foram comprometidos.
Além de fornecer serviços de validação do sistema computacional (CSV), os consultores de conformidade Agilent CrossLab podem ajudá-lo a realizar a análise de hiato da integridade dos dados e a validação do método.