即便执行了强大的数据可靠性 (DI) 计划,在为监管检查做准备时仍不免忧心万分。如果您了解为什么 DI 检查在今天变得越来越普遍,审计员关注的是什么以及如何回答他们的问题,那么准备工作会变得更容易。
本文总结了 DI 检查的典型范围和重点,并提供了简化、加快和成功通过下一次 DIO(数据可靠性观察)审计的六个最佳实践技巧。
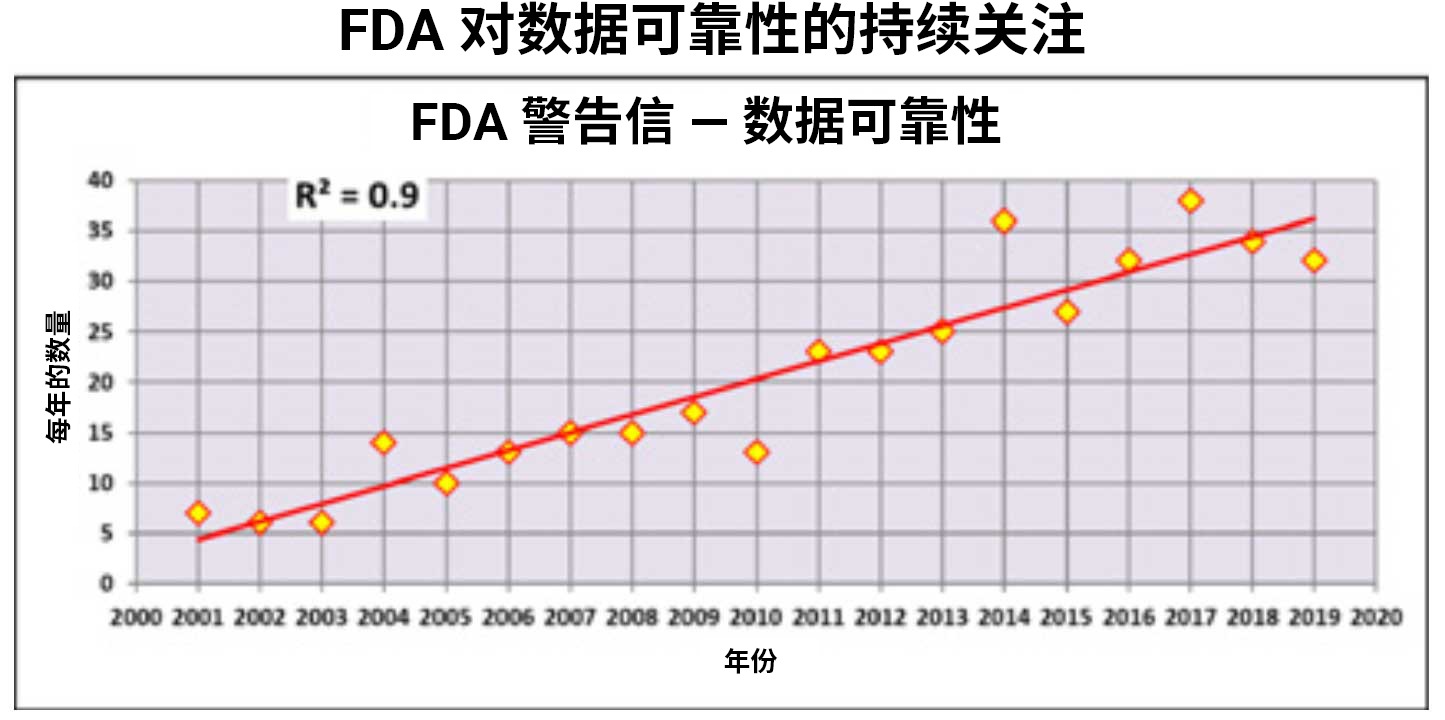
DI 问题越来越受关注
在过去 20 年中,监管机构不断加强对数据可靠性的审查力度,检查员将大部分注意力集中在了 CDS 问题上,例如非正式测试、数据删除、未保护好电子记录、反复积分直到获得合格结果,以及将超标 (OOS) 结果选择性作废。
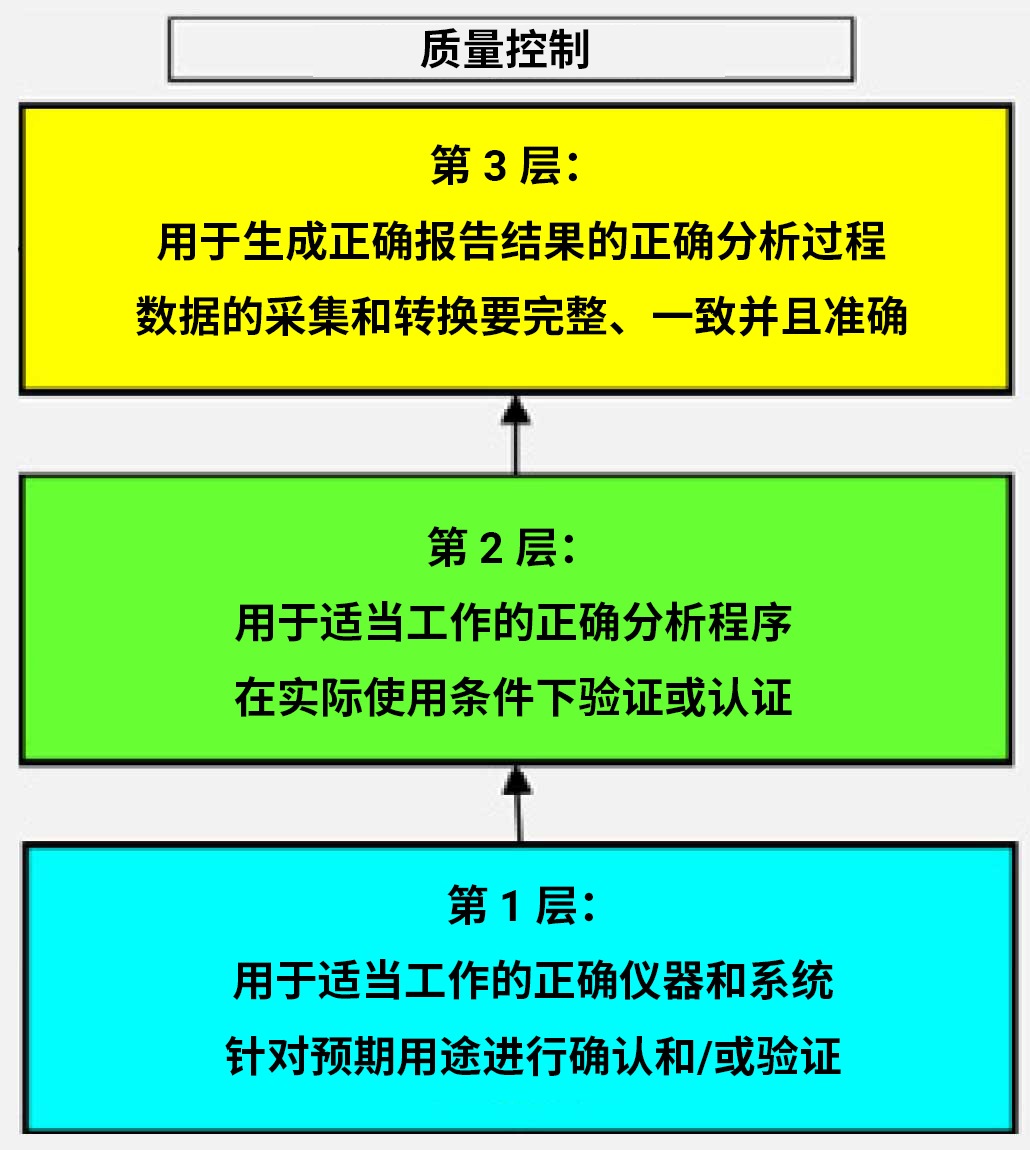
虽然检查过程不尽相同,但检查范围通常是一样的。常规 FDA 检查的重点范围如下所示。第一层与实验室中使用的仪器和信息管理系统的验证有关。所有设备必须使用参比标样进行校准。第二层包括其使用的程序和方法。分析必须使用适当的分析程序,必须在实际使用条件下对方法进行验证和认证。最高一层是样品分析。必须采用正确的分析才能获得相应的结果。
任何一层失败都将导致在它之上的每一层失效。如果未建立适当的分析程序,将无法进行正确的分析;如果仪器未经过验证和校准,则无法执行分析和程序。
1.在 CDS 上启用审计追踪。
应始终启用 CDS 软件上所有可用的审计追踪。电子审计追踪使相关记录便于审查,并有助于实现彻底的调查。此外,应建立针对定期审计追踪审查的程序,作为结果审批的一部分,以验证报告的结果是否有效。
2.务必使用电子签名。
在 CDS 软件中使用电子签名可加快检查和批准速度。每个用户必须持有自己的唯一账户,且不得共享,并在复核后锁定数据,防止出现可能破坏报告结果可信度的其他更改。使用多级签名来控制对签名应用的访问权限,并按顺序执行签名,以支持所记录的工作流程。
3.谨慎授予访问权限。
要符合美国 FDA 联邦法规 (CFR) 第 21 章第 11 款 (21 CFR Part 11) 的要求,必须控制用户对系统的访问。设置系统时,根据用户的岗位职责和具体的工作流程向用户授予权限非常重要。只能授予用户完成其工作所需的功能的访问权限。最佳做法是根据具体角色建立组权限,使系统管理员可以轻松维护和查看。
4.确保明确定义所有角色。
为防止利益冲突,请明确定义并记录数据系统用户所持有的访问权限,包括角色划分以防止利益冲突。首先定义各个用户组,并根据各组用户的职责来确定其可执行的操作。使用这些定义来配置系统权限,并能证明其与文档同步。
5.预计会询问有关运行中止的情况。
检查员将调查系统的实际使用情况。系统短时间运行或运行中止,或者孤立样品/孤立数据表明某些分析可能存在问题,检查员希望了解实验室人员是如何处理这些问题的。例如,在样品重量输入错误时考虑会发生什么情况。如果发现此类问题,检查员会要求提供处理该问题的详细记录。
6.让第二人复核成为例行操作。
第二人复核的范围应涵盖从采样到结果报告的所有内容。由经验丰富的分析人员正确、积极地执行此操作至关重要。复核人应关注样品前处理记录和手动输入 CDS 序列文件的数据(例如重量、纯度或稀释度),并应确保峰积分,尤其是手动积分正确无误。
确保检查过程顺利的最后一条常规建议是:只回答问题相关内容,但如果询问的问题存在能支持回答的验证文档时,最好准备好该文档。这将使检查过程更加顺利,并避免使检查员反感或怀疑您有所隐瞒。
OpenLab CDS:促进合规性的功能
OpenLab CDS 是一款以多种方式帮助您更轻松地符合数据可靠性法规要求的色谱数据系统。例如,它提供了:
- 安全的中央存储
- 通过自定义计算器工具避免抄录错误,确保所有计算都在色谱系统内进行,而不是手动或自动导出到外部电子表格应用程序
- 覆盖整个系统的审计追踪功能,审计追踪中的技术控制可突出显示数据的更改和删除以简化复核流程
- CDS 应用程序内的功能,用于记录审计追踪条目已经过审核
了解更多信息
如需了解关于 DI 检查的更详细建议,请查看下面的相关内容。