Integrità del dato assicurata per la qualifica degli strumenti analitici

Riduci al minimo i rischi dell'audit e delle ispezioni degli enti regolatori con i servizi per la conformità Agilent CrossLab
I laboratori farmaceutici e qualsiasi altro laboratorio i cui risultati siano soggetti a requisiti normativi devono provare e documentare l'adeguatezza degli strumenti analitici per l'uso previsto. Per soddisfare tali requisiti, i laboratori possono eseguire una qualifica degli strumenti analitici (AIQ).
La United States Pharmacopoeia è l'unica tra le principali farmacopee a prevedere un capitolo generale dedicato alla qualifica degli strumenti analitici: l'USP <1058>. Questo significa che le modifiche apportate al capitolo <1058> hanno ricadute globali. La versione 2017 del capitolo USP <1058>, entrata in vigore in data 1 agosto 2017, è un documento normativo fondamentale con implicazioni rilevanti per il tuo laboratorio.
Agilent può aiutarti a implementare un processo di qualifica conveniente sotto il profilo dei costi e ad allineare le SOP affinché siano conformi alla versione 2017 dei requisiti USP <1058>, adottando un approccio alla qualifica degli strumenti analitici integrato e basato sul ciclo di vita.
Cosa devi sapere sulla versione 2017 del capitolo USP <1058>
Approccio alla qualifica degli strumenti basato sul ciclo di vita secondo la versione 2017 del capitolo USP <1058>:il modo migliore per tutelare il tuo laboratorio nel corso di un audit
Qualifica degli strumenti: l'approccio basato sul ciclo di vita
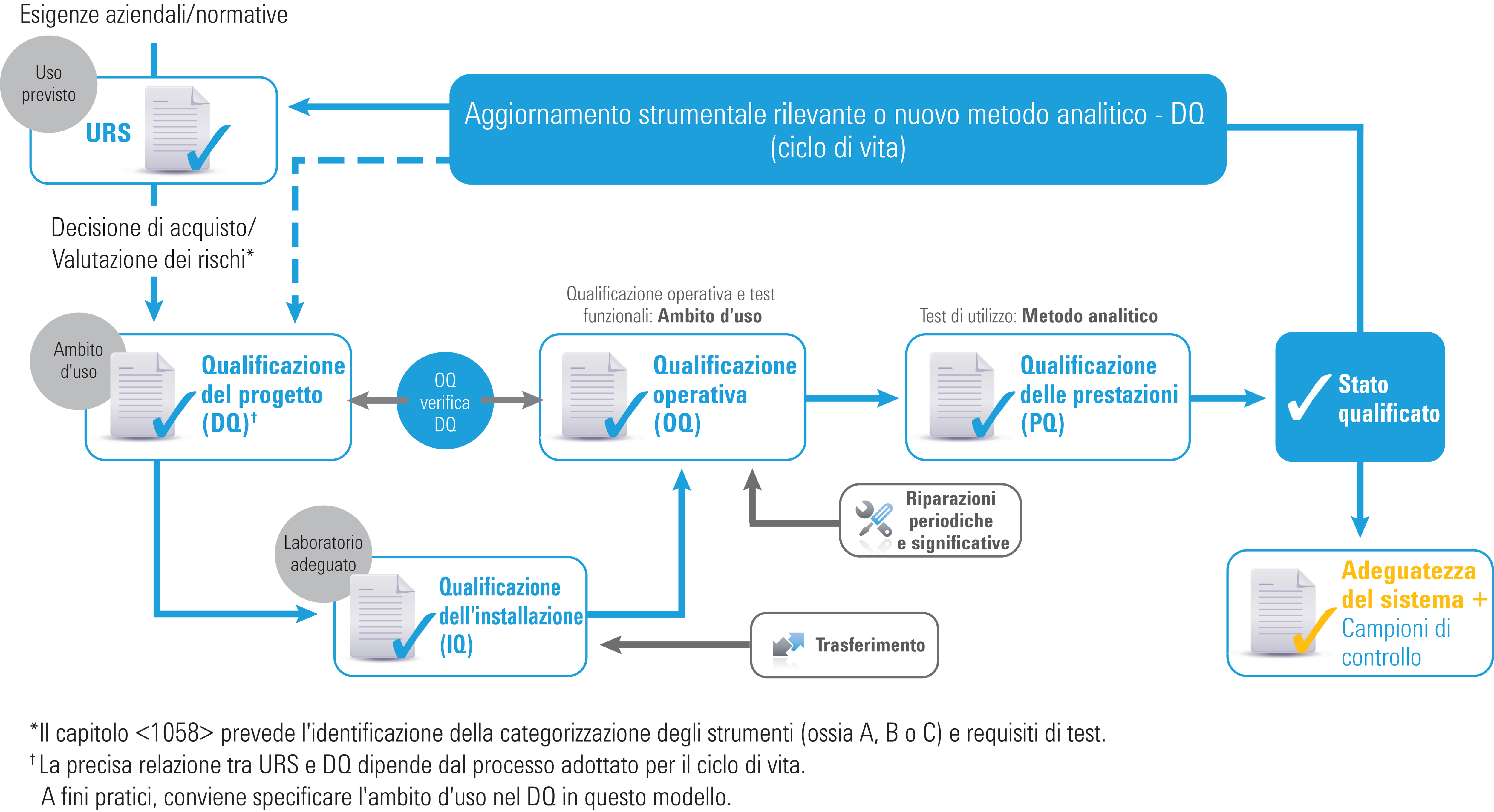
Ciclo di vita della qualifica degli strumenti
La versione 2017 del capitolo USP <1058> riflette l'evoluzione della qualifica degli strumenti analitici, che ora abbraccia l'intera durata dello strumento. Alcune delle linee guida sono state preservate, tra cui:
- Gruppi di strumenti A, B e C (sebbene gli esempi siano stati eliminati)
- Le “4Q”: qualificazione del progetto (DQ), qualificazione dell'installazione (IQ), qualificazione operativa (OQ) e qualificazione delle prestazioni (PQ)
Sono state tuttavia introdotte numerose differenze cruciali che chiariscono i ruoli delle 4Q e le relazioni che intercorrono tra le stesse. Inoltre, la sezione relativa al software è stata notevolmente ampliata.
Le modifiche più rilevanti includono:
- l'URS (specifica dei requisiti utilizzatore) è divenuta obbligatoria
- i test OQ ora sono “collegati” a URS/DQ
- l'OQ (funzionalità e ambito d'uso) è divenuta obbligatoria
- la PQ (applicazione/uso previsto) è divenuta obbligatoria
- DQ, OQ e PQ ora sono allineate in maniera dinamica all'uso degli strumenti
Le conseguenze per il tuo laboratorio:
Politiche e procedure esistenti associate al ciclo di vita degli strumenti analitici possono non essere completamente conformi alla versione 2017 del capitolo USP <1058> e dovranno essere aggiornate.
I consulenti dei servizi per la conformità Agilent CrossLab possono aiutare il tuo laboratorio a implementare processi di qualifica già allineati alla versione 2017 del capitolo USP <1058>.
Un approccio integrato tra la validazione del software e la qualifica degli strumenti:allineamento tra USP <1058> e GAMP®
Qualifica senza soluzione di continuità

* I requisiti che prevedono l'inclusione di una specifica matrice di tracciabilità dei requisiti nel ciclo di vita della qualifica dipendono dall'uso previsto, dalla complessità degli strumenti e dalla politica aziendale. GAMP è un marchio registrato di ISPE. Fare riferimento al sito web ISPE per le pubblicazioni GAMP: www.ispe.org/publications/guidance-documents
Approccio integrato alla qualifica dell'hardware e alla validazione del software
Il significativo ampliamento dei requisiti software, abbinato alla rimozione degli esempi di strumenti per i gruppi A, B e C, si traduce in un più stretto allineamento tra il capitolo USP <1058> e le linee guida GAMP® 5.
In passato il capitolo USP <1058> semplificava il processo di introduzione degli strumenti dei gruppi A e B nei laboratori regolamentati. L'aggiornamento 2017 estende questo vantaggio anche ad alcuni strumenti del gruppo C.
Tuttavia, in base ai requisiti 2017 del capitolo USP <1058>, è necessaria una valutazione dei rischi per identificare una categoria per ciascuno strumento. Di conseguenza, i laboratori saranno tenuti a giustificare le categorizzazioni dei loro strumenti, oltre che ad aggiornare le proprie procedure in modo da definire in maniera omogenea la categorizzazione in base all'uso degli strumenti.
Nel complesso, le modifiche introdotte fanno sì che la versione 2017 del capitolo USP <1058> possa ora essere considerata un continuo di opzioni di qualifica allineate con la guida alle buone prassi (GPG) GAMP per i sistemi computerizzati di laboratorio (ISBN 978-1-936379-49-1) e GAMP 5 (ISBN 1-931879-61-3). Nello specifico:
- Consultare il capitolo USP <1058> per gli strumenti standard (per esempio HPLC, GC)
- Consultare la guida GPG GAMP per gli strumenti complessi (per esempio QTOF)
- Consultare la guida GAMP 5 per la validazione di software specifico
Le conseguenze per il tuo laboratorio:
Per ottenere la conformità del laboratorio, è necessario che la qualifica degli strumenti analitici sia in linea con la versione 2017 del capitolo USP <1058>. Il processo include tutte le SOP associate e i documenti sulle politiche del ciclo di vita della qualifica degli strumenti analitici.
I consulenti dei servizi per la conformità Agilent CrossLab sono a tua disposizione per aiutarti a valutare i rischi della validazione dei sistemi informatici (CSV) e a implementare/validare sistemi e software.
Governance dei dati nei laboratori analitici:le fondamenta di una solida
integrità dei dati
Qualifica e integrità dei dati
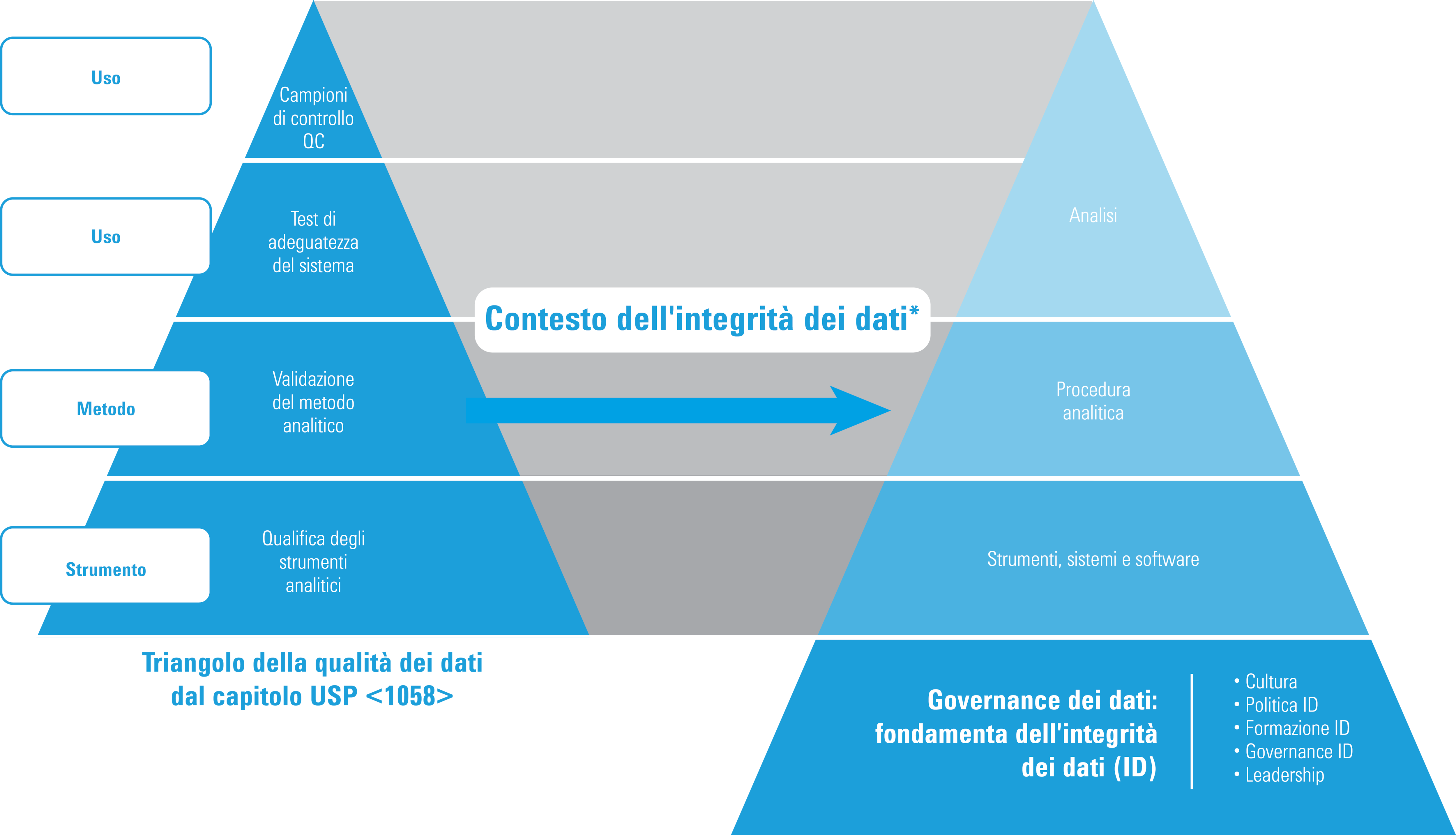
* Adattato con autorizzazione da ISBN 978-1-84973-662-6
La rilevanza dell'integrità dei dati
I risultati delle ispezioni di audit relativi alle violazioni dei dati spingono gli enti regolatori di tutto il mondo a guardare con maggiore interesse all'integrità dei dati. Per un certo periodo, la conseguenza è stata una minore attenzione dedicata alle aree tradizionali dell'audit, per esempio la qualifica degli strumenti analitici. Tuttavia, le recenti ispezioni FDA 483 suggeriscono che gli enti regolatori hanno cominciato a porre nuovamente l'accento su integrità dei dati, tracciabilità e contenuto tecnico dei report di qualifica degli strumenti analitici.
Il triangolo della qualità dei dati è rimasto invariato nella versione 2017 del capitolo USP <1058>; tuttavia, nell'ottica dell'integrità dei dati, il triangolo si è evoluto generando il modello qui riportato. In particolare:
- La qualifica degli strumenti analitici costituisce le fondamenta sulle quali poggia il triangolo della qualità dei dati del capitolo USP <1058>.
- Attività ripetute o ripetizioni delle analisi devono essere gestite e giustificate (documentate).
- La tracciabilità dei dati ora costituisce un requisito fondamentale.
- La governance dei dati ora costituisce le fondamenta di tutti i dati di qualità.
Le conseguenze per il tuo laboratorio:
I problemi di integrità dei dati genereranno un numero senza precedenti di interventi normativi. Per difendere con successo i tuoi risultati, devi essere pronto a dimostrare che i dati ottenuti non sono stati compromessi.
Oltre a fornire servizi di validazione dei sistemi informatici (CSV), i consulenti dei servizi per la conformità Agilent CrossLab possono aiutarti a svolgere l'analisi delle lacune dell'integrità dei dati e la validazione del metodo.