Intégrité des données assurée pour la qualification d’instruments analytiques

Réduisez au minimum le risque lié aux audits et aux inspections réglementaires avec les services de mise en conformité Agilent
Les laboratoires pharmaceutiques, ainsi que tous les laboratoires qui génèrent des résultats soumis à des exigences réglementaires, doivent démontrer et documenter l’adéquation entre les instruments analytiques et leur utilisation prévue. Les laboratoires peuvent satisfaire à ces exigences en effectuant une qualification d’instruments analytiques (AIQ).
United States Pharmacopeia est la seule pharmacopée majeure avec un chapitre général dédié à l’AIQ, l’USP <1058>. Par conséquent, les modifications apportées à <1058> sont d’une importance mondiale. La version 2017 de l’USP <1058> est entrée en vigueur le 1er août 2017 et il s’agit d’un document réglementaire essentiel qui possède des implications primordiales pour votre laboratoire.
Agilent peut vous aider à mettre en œuvre un processus de qualification rentable et à aligner vos modes opératoires normalisés pour vous conformer aux exigences de la version 2017 de l’USP <1058>, en suivant une approche de l’AIQ intégrée et basée sur le cycle de vie.
Ce que vous devez savoir sur la version 2017 de l’USP <1058>
L’approche axée sur le cycle de vie de la qualification d’instruments dans la version 2017 de l’USP <1058> :la meilleure façon de défendre votre laboratoire pendant un audit
Qualification d’instruments : approche axée sur le cycle de vie
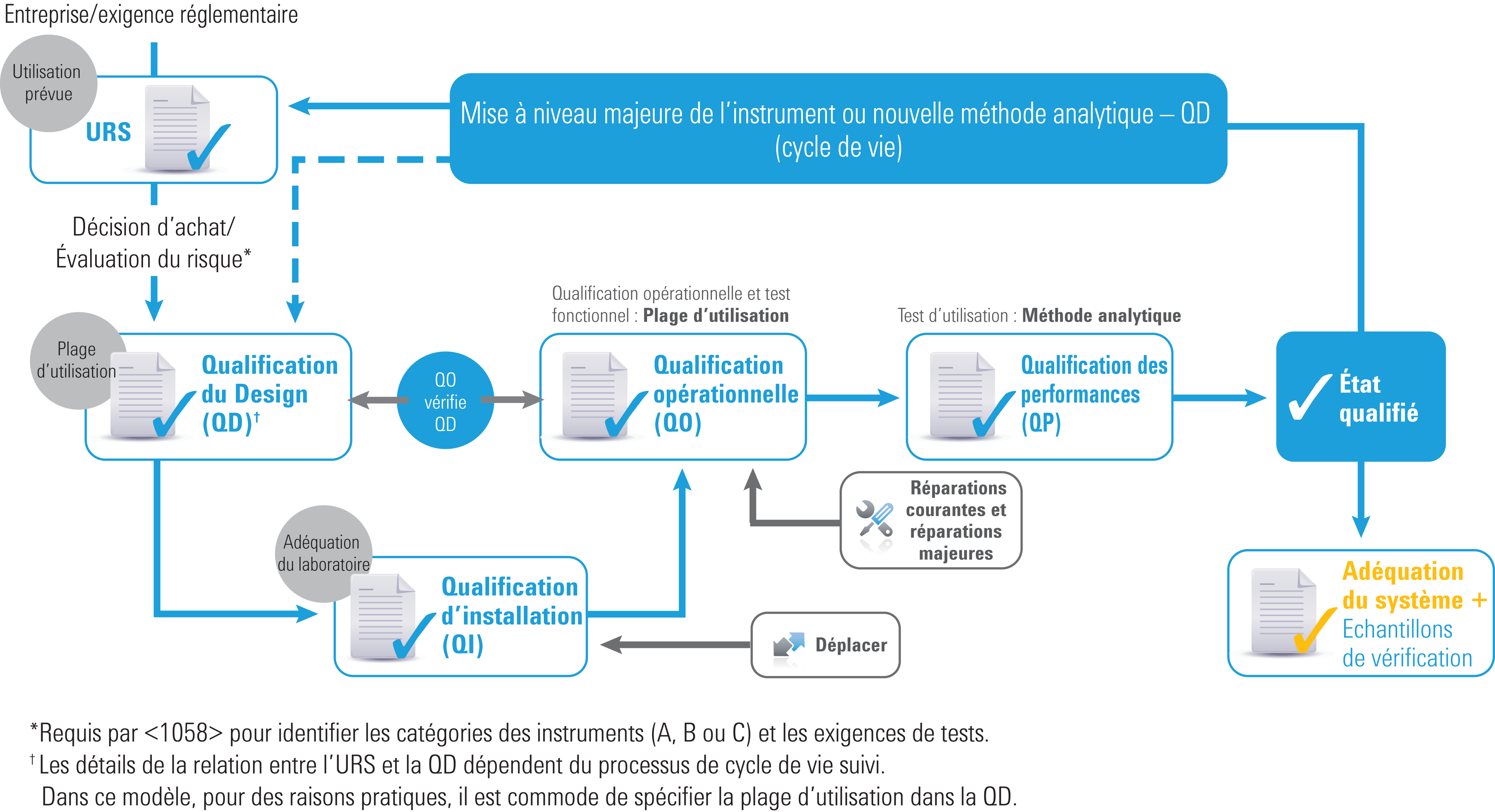
Cycle de vie de la qualification d’instruments
La version de l’USP <1058> révisée en 2017 reflète les évolutions de l’AIQ afin d’incorporer l’intégralité du cycle de vie des instruments. Certaines recommandations ont été conservées, y compris :
- Les groupes d’instruments A, B et C (bien que certains exemples aient été supprimés)
- Le modèle « 4Q » : qualification du Design (QD), qualification d’installation (QI), qualification opérationnelle (QO) et qualification des performances (QP)
Toutefois, il existe de nombreuses différences essentielles qui clarifient les rôles des quatre types de qualification et les relations entre ces derniers. De plus, la section sur les logiciels a été considérablement développée.
Les changements les plus importants incluent :
- La spécification des exigences de l’utilisateur (URS) est désormais requise
- Les tests de QO sont désormais « liés » à l’URS et à la QD
- La QO (fonctionnalité et plage d’utilisation) est désormais requise
- La QP (utilisation prévue/application) est désormais requise
- QD, QO et QP sont désormais alignées sur l’utilisation de l’instrument
Ce que cela signifie pour votre laboratoire :
Les politiques existantes et les procédures associées au cycle de vie de vos instruments analytiques ne sont peut-être pas conformes avec la version 2017 de l’USP <1058> et nécessitent d’être réactualisées.
Les consultants de mise en conformité Agilent CrossLab peuvent aider votre laboratoire à mettre en œuvre des processus de qualification qui sont déjà alignés sur l’USP <1058> de 2017.
Une approche intégrée entre la validation des logiciels et la qualification d’instruments :alignement de l’USP <1058> sur le GAMP (BPFA)®
Continuum de qualification

* Les exigences relatives à l’inclusion d’une matrice spécifique de traçabilité des exigences dans le cycle de vie de qualification dépendent de l’utilisation prévue, de la complexité de l’instrument et de la politique d’entreprise. GAMP est une marque déposée de l’ISPE (International Society for Pharmaceutical Engineering). Reportez-vous au site suivant de l’ISPE pour les recommandations de GAMP : www.ispe.org/publications/guidance-documents
Approche intégrée à la qualification du matériel et à la validation des logiciels
Le développement considérable des exigences sur les logiciels, associé à la suppression d’exemples d’instruments pour les groupes A, B et C, signifie que l’USP <1058> est désormais plus étroitement alignée avec GAMP® 5.
Historiquement, l’USP <1058> a simplifié le processus d’introduction des instruments des groupes A et B dans les laboratoires réglementés. La réactualisation de 2017 étend cette simplification à certains instruments du groupe C.
Cependant, la version 2017 des exigences de l’USP <1058> spécifie une évaluation du risque pour classer chaque instrument dans une catégorie. En conséquence, les laboratoires devront justifier la classification de leurs instruments et actualiser leurs procédures, afin de définir de façon cohérente les catégories basées sur l’utilisation des instruments.
Ensemble, ces modifications permettent désormais de considérer la version 2017 de l’USP <1058> comme un continuum d’options de qualification alignées sur les documents suivants : GAMP Good Practice Guide (GPG) for Laboratory Computerized Systems (ISBN 978-1-936379-49-1) et GAMP 5 (ISBN 1-931879-61-3). En particulier :
- Utilisez l’USP <1058> pour les instruments standard (p. ex. HPLC, GC)
- Utilisez GAMP GPG pour les instruments complexes (p. ex. QTOF)
- Utilisez GAMP 5 pour la validation des logiciels sur mesure
Ce que cela signifie pour votre laboratoire :
Pour que votre laboratoire soit conforme, vous devez aligner votre AIQ sur la version 2017 de l’USP <1058>. Cela comprend tous les modes opératoires associés et tous les documents sur la politique de cycle de vie de l’AIQ.
Les consultants sur la mise en conformité Agilent CrossLab sont à votre disposition pour vous aider à évaluer votre risque de validation du système informatique et à mettre en œuvre/valider vos systèmes et vos logiciels.
La gouvernance des données dans les laboratoires analytiques :la base d’une solide
intégrité des données
Qualification et intégrité des données
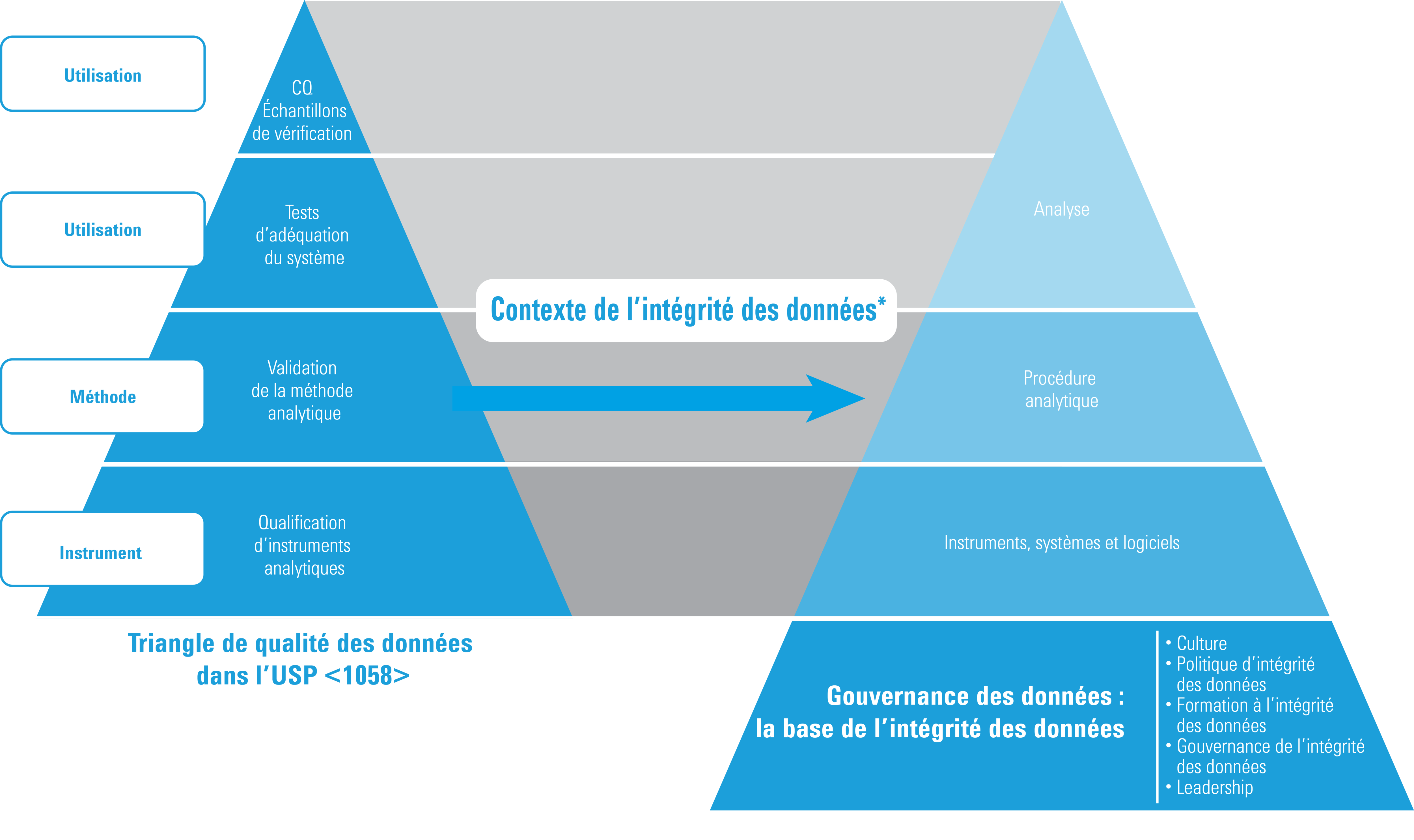
* Adaptation autorisée d’ISBN 978-1-84973-662-6
L’importance de l’intégrité des données
Les atteintes aux données qui ont été constatées lors des audits de conformité à la réglementation ont incité les organismes de réglementation du monde entier à se pencher de plus près sur l’intégrité des données. Pendant un certain temps, cela s’est traduit par une baisse de l’attention portée aux domaines traditionnellement prioritaires des audits, comme l’AIQ. Toutefois, les récents formulaires 483 de la FDA indiquent que les régulateurs ont recommencé à s’intéresser en détail à l’intégrité des données, à la traçabilité et au contenu technique des rapports d’AIQ.
Le triangle de la qualité des données demeure inchangé dans la version 2017 de l’USP <1058>. Cependant, du point de vue de l’intégrité des données, ce triangle s’est transformé pour devenir le modèle présenté ici. En particulier :
- L’AIQ constitue la base du triangle de qualité des données de l’USP <1058>
- Les tâches et les analyses faites à nouveau doivent être gérées et expliquées (documentées)
- La traçabilité des données est désormais une exigence clé
- La gouvernance des données est désormais la base de toutes les données de qualité
Ce que cela signifie pour votre laboratoire :
Les problèmes d’intégrité des données aboutiront à plus d’actions réglementaires que jamais auparavant. Pour défendre vos résultats avec succès, vous devez être prêt à prouver que vos données n’ont pas été compromises.
En plus de proposer des services de validation du système informatique, les consultants de mise en conformité Agilent CrossLab peuvent vous aider à réaliser l’analyse des écarts d’intégrité des données et la validation des méthodes.