Garantice la integridad de los datos para la cualificación de sus instrumentos analíticos

Minimice el riesgo en las auditorías y en las inspecciones normativas con los servicios de conformidad Agilent CrossLab
Los laboratorios farmacéuticos (o cualquier laboratorio que produzca resultados sujetos a requisitos reglamentarios) deben demostrar y documentar que los instrumentos analíticos son adecuados para su uso previsto. Los laboratorios pueden satisfacer estos requisitos realizando una cualificación de los instrumentos de análisis (AIQ).
La Farmacopea de Estados Unidos (USP) es la única farmacopea importante que dedica un capítulo general a la cualificación de los instrumentos de análisis: USP <1058>; en consecuencia, las modificaciones realizadas en la <1058> tienen trascendencia internacional. La versión de 2017 de la USP <1058> entró en vigor el 1 de agosto de 2017; se trata de un documento normativo clave con significativas implicaciones para su laboratorio.
Agilent puede ayudarle a implantar un proceso de cualificación de forma económica y a ajustar sus PNTs para que cumplan con los requisitos de la USP <1058> de 2017, asumiendo un planteamiento integrado y basado en el ciclo de vida para la cualificación de los instrumentos de análisis.
Lo que necesita saber sobre la USP <1058> de 2017
Planteamiento de ciclo de vida para la cualificación de los instrumentos según la USP <1058> de 2017:El mejor modo de defender su laboratorio durante una auditoría
Cualificación de los instrumentos: planteamiento del ciclo de vida
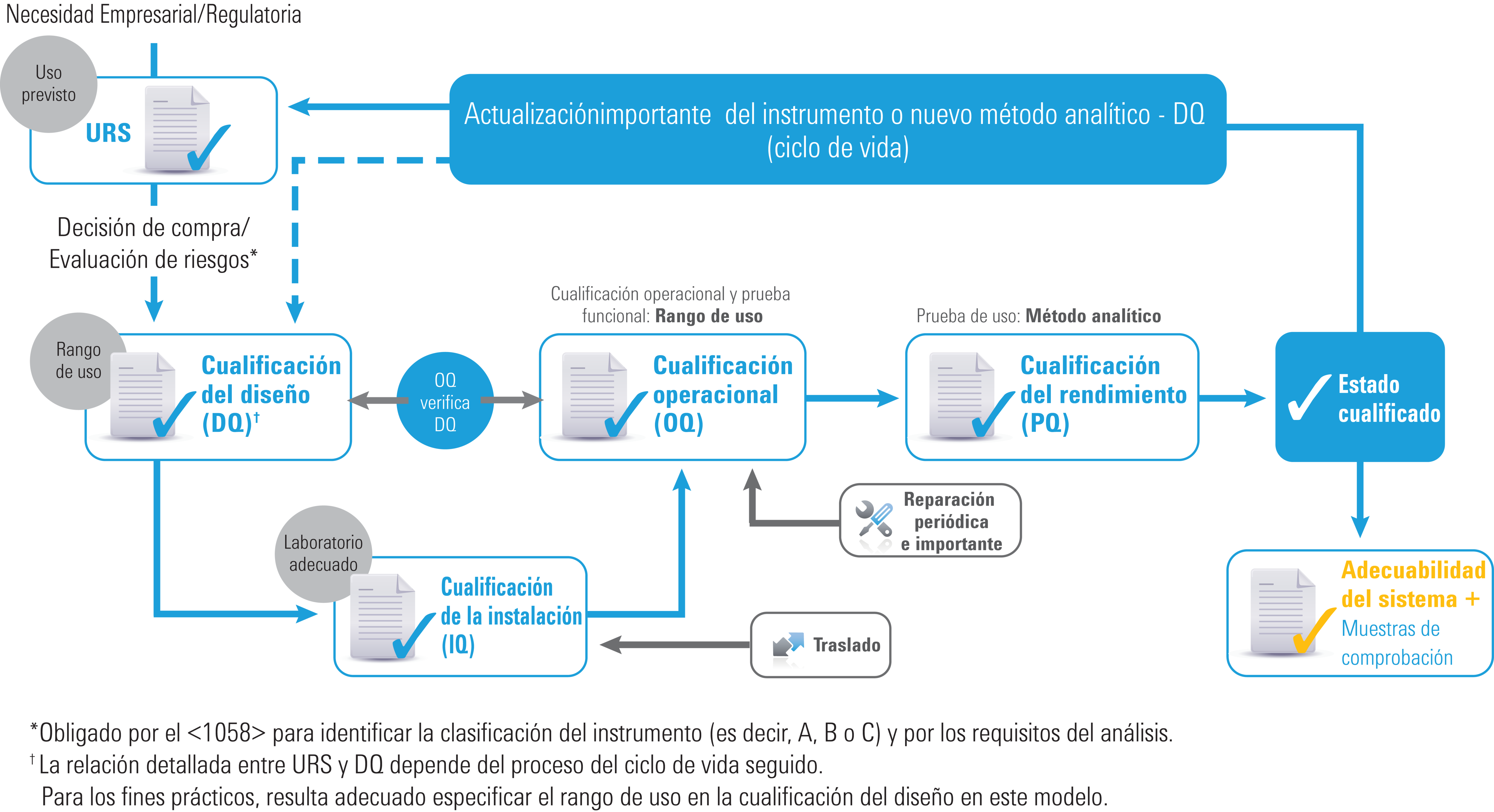
Ciclo de vida de cualificación de los instrumentos
El capítulo USP <1058> de 2017 revisado refleja el modo en que ha evolucionado la cualificación de los instrumentos de análisis para incorporar todo el ciclo de vida instrumental. Se han conservado algunas de las directrices, como las siguientes:
- Los grupos de instrumentos A, B y C (aunque se han eliminado los ejemplos)
- Las “4Q”: cualificación del diseño (DQ), cualificación de la instalación (IQ), cualificación operacional (OQ) y cualificación del rendimiento (PQ)
Sin embargo, hay muchas diferencias importantes que aclaran las funciones de las 4Q, así como sus interrelaciones. Además, el apartado sobre software se ha ampliado considerablemente.
Los cambios más importantes son:
- Ahora es obligatoria la especificación de los requisitos de los usuarios (URS)
- El análisis de OQ están ahora “vinculadas” con URS/DQ
- Ahora es obligatoria la OQ (funcionalidad y rango de uso)
- Ahora es obligatoria la PQ (aplicación y uso previstos)
- DQ, OQ y PQ están ahora alineadas de forma dinámica con el uso del instrumento
Qué implica todo esto para su laboratorio:
Las políticas y los procedimientos existentes relacionados con el ciclo de vida de sus instrumentos analíticos podrían no cumplir totalmente con la USP <1058> de 2017 y será necesario actualizarlos.
Los consultores en materia de conformidad de Agilent CrossLab pueden ayudar a su laboratorio a implantar procesos de cualificación que ya estén en sintonía con la USP <1058> de 2017.
Un planteamiento integrado entre la validación del software y la cualificación de los instrumentos:Alineamiento de la USP <1058> con GAMP®
El continuum de la cualificación

* Los requisitos para incluir en el ciclo de vida de la cualificación una matriz de trazabilidad de requisitos específica dependen del uso previsto, de la complejidad de los instrumentos y de la política de la compañía. GAMP es una marca comercial registrada de ISPE. Consulte en la página web de ISPE las publicaciones de GAMP: www.ispe.org/publications/guidance-documents
Planteamiento integrado para la cualificación del hardware y la validación del software
El significativo aumento de los requisitos de software (junto con la eliminación de los ejemplos de instrumentos para los grupos A, B y C) supone que la USP <1058> está ahora en consonancia más estrecha con GAMP®5
Históricamente, la USP <1058> ha simplificado el proceso de introducir los instrumentos de los grupos A y B en los laboratorios regulados. La actualización de 2017 amplía esta ventaja a algunos instrumentos del grupo C.
Sin embargo, los requisitos de la USP <1058> de 2017 especifican una evaluación de riesgos para identificar una categoría para cada instrumento. En consecuencia, los laboratorios deberán justificar la clasificación de sus instrumentos y actualizar sus procedimientos para definir uniformemente la clasificación en función del uso de los instrumentos.
Combinadas, estas modificaciones hacen que ahora pueda considerarse la USP <1058> de 2017 un continuum de opciones de cualificación en consonancia con la guía de buenas prácticas (GBG) de GAMP para sistemas informatizados de laboratorio (ISBN 978-1-936379-49-1) y GAMP 5 (ISBN 1-931879-61-3). Específicamente:
- Use la USP <1058> para instrumentos convencionales (como HPLC, GC)
- Use GAMP GPG para instrumentos complejos (como QTOF)
- Use GAMP 5 para la validación del software personalizado
Qué implica todo esto para su laboratorio:
Para que su laboratorio cumpla con la normativa, deberá alinear su cualificación de los instrumentos de análisis con la USP <1058> de 2017. Esto incluye todos los PNT asociados y los documentos de la política del ciclo de vida de la cualificación de los instrumentos de análisis.
Agilent CrossLab pone a su disposición a consultores en materia de conformidad para ayudarle a evaluar los riesgos de su validación de sistemas informáticos (CSV) y a implantar/validar sus sistemas y su software.
Gestión de los datos en laboratorios analíticos:Las bases para una
integridad de los datos sólida
Cualificación e integridad de los datos
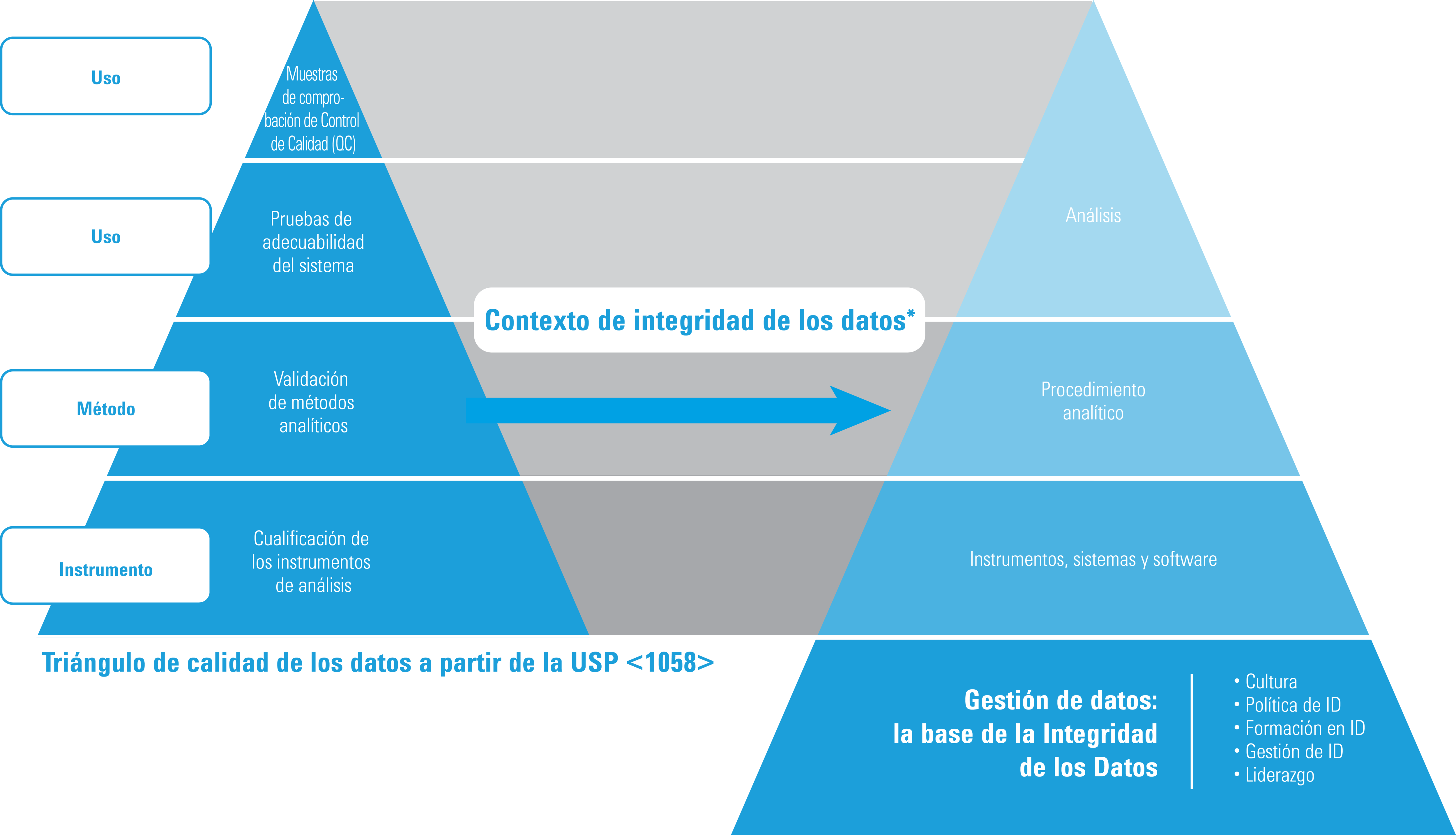
* Adaptado con permiso de ISBN 978-1-84973-662-6
La importancia de la integridad de los datos
Los resultados de las auditorías en entorno regulado asociados con fallos de seguridad de los datos hacen que los organismos de regulación de todo el mundo examinen estrechamente la integridad de los datos. Durante un tiempo, esto hizo que se prestara menos atención a las áreas donde se centraban tradicionalmente las auditorías, como la cualificación de los instrumentos de análisis. Sin embargo, los recientes formularios 483 de la FDA indican que los reguladores han comenzado a investigar de nuevo con detalle la integridad de los datos, la trazabilidad y el contenido técnico de los informes de cualificación de los instrumentos de análisis.
El triángulo de calidad de los datos permanece invariable en la USP <1058> de 2017; no obstante, desde el punto de vista de la integridad de los datos, el triángulo ha evolucionado hasta el modelo que aquí se muestra. En particular:
- La AIQ es la base del triángulo de calidad de los datos de la USP <1058>
- El trabajo repetido o las repeticiones de análisis deben poder gestionarse y explicarse (documentarse).
- La trazabilidad de los datos constituye ahora un requisito fundamental
- La gestión de los datos forma ahora la base de todos los datos de calidad
Qué implica todo esto para su laboratorio:
Los problemas de integridad de los datos generarán más medidas normativas que anteriormente. Para defender sus resultados con éxito, debe estar preparado para demostrar que sus datos no se han visto comprometidos.
Además de proporcionar servicios de validación de sistemas informáticos (CSV), los consultores en materia de conformidad de Agilent CrossLab pueden ayudarle a realizar el análisis de riesgos en la integridad de los datos y la validación de métodos.