Garantierte Datenintegrität für die Qualifizierung analytischer Geräte

Gehen Sie bei behördlichen Audits und Inspektionen keine Risiken ein - mit Agilent CrossLab Compliance Services
Pharmazeutische Labore - sowie alle Labore, die behördlichen Anforderungen unterliegen - müssen die Eignung ihrer analytischen Geräte für deren jeweiligen Verwendungszweck nachweisen und dokumentieren. Labore können diesen Anforderungen durch eine Qualifizierung der analytischen Geräte (Analytical Instrument Qualification, AIQ) nachkommen.
Die United States Pharmacopeia ist die einzige wichtige Pharmakopöe mit einem allgemeinen Kapitel, das der AIQ gewidmet ist: USP <1058>. Daher sind Änderungen an USP <1058> von umfassender Bedeutung. Am 1. August 2017 trat eine neue Version von USP <1058> in Kraft – ein regulatorisches Schlüsseldokument mit erheblichen Auswirkungen auf Ihr Labor.
Agilent kann Sie bei der Einführung eines kostengünstigen Qualifizierungsverfahrens und der Anpassung Ihrer SOPs mithilfe eines integrierten, am Lebenszyklus orientierten Ansatzes der AIQ unterstützen, damit Ihr Labor die Anforderungen von 2017 USP <1058> erfüllt.
Was Sie über 2017 USP <1058> wissen müssen
Am Lebenszyklus orientierter Ansatz bei der Gerätequalifikation gemäß 2017 USP <1058>:Die beste Art, Ihr Labor fit für ein Audit zu machen
Gerätequalifizierung – ein am Lebenszyklus orientierter Ansatz
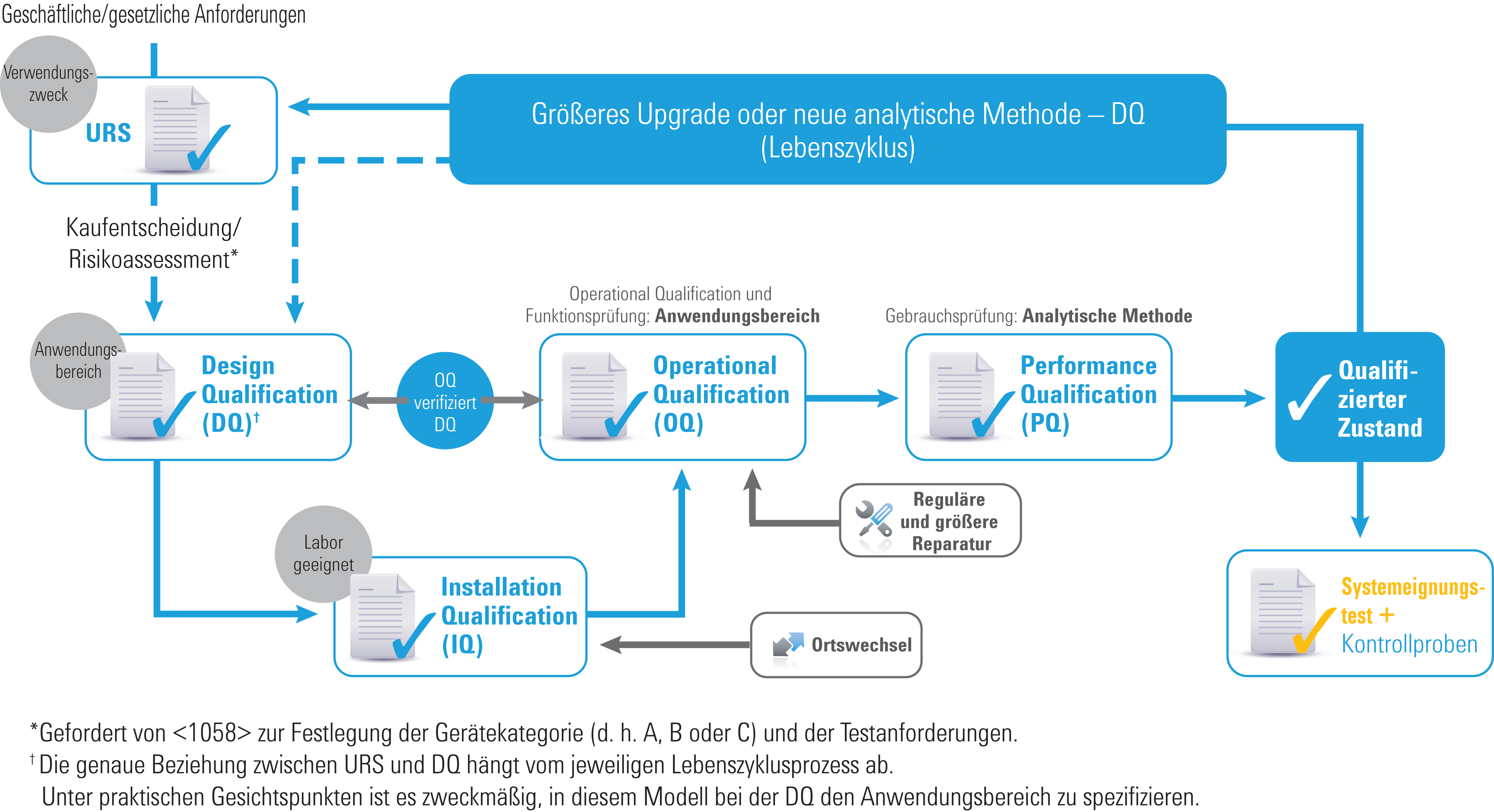
Qualifizierung und Gerätelebensdauer
Das überarbeitete 2017 USP <1058> spiegelt wider, wie die AIQ weiterentwickelt wurde, um die gesamte Lebensdauer eines Geräts abzudecken. Einige Richtlinien wurden beibehalten, darunter:
- Gerätegruppen A, B und C (wobei die Beispiele gestrichen wurden)
- Die „4Qs“: Design Qualification (DQ), Installation Qualification (IQ), Operational Qualification (OQ) und Performance Qualification (PQ)
Jedoch gibt es einige wichtige Änderungen, die die Klarstellung der Rolle der 4Qs sowie ihrer Beziehungen zueinander zum Ziel haben. Darüber hinaus wurde der Abschnitt zur Software stark erweitert.
Die wichtigsten Änderungen:
- URS (User Requirement Specification) ist nun erforderlich
- OQ-Prüfungen sind nun mit der URS/DQ verknüpft
- OQ (Funktion und Anwendungsbereich) ist nun erforderlich
- PQ (Verwendungszweck/Applikation) ist nun erforderlich
- DQ, OQ und PQ werden nun dynamisch an die Verwendung des Geräts angepasst
Was bedeutet das für Ihr Labor?
Bisherige Richtlinien und Verfahren bezüglich des Lebenscyclus Ihrer analytischen Geräte sind u. U. nicht vollständig kompatibel mit 2017 USP <1058> und müssen aktualisiert werden.
Agilent CrossLab Compliance-Berater können Ihr Labor bei der Einführung von Qualifizierungsverfahren unterstützen, die bereits an das 2017 USP <1058> angepasst sind.
Ein integrierter Ansatz für die Software-Validierung und Gerätequalifikation:Abstimmung von USP <1058> mit GAMP®
Qualifizierungskontinuum

* Die Anforderungen hinsichtlich der Aufnahme einer spezifischen Abhängigkeitsmatrix in den Qualifizierungslebenszyklus hängen vom Verwendungszweck, der Komplexität des Geräts und den Unternehmensrichtlinien ab. GAMP ist eine eingetragene Marke der ISPE. Publikationen zur GAMP finden Sie auf der Website der ISPE: www.ispe.org/publications/guidance-documents
Ein integrierter Ansatz für die Hardware-Qualifizierung und Software-Validierung
Die erhebliche Erweiterung der Software-Anforderungen - zusammen mit der Streichung der Beispiele für die Gerätegruppen A, B und C - hat zur Folge, dass USP <1058> und GAMP® 5 nun enger aufeinander abgestimmt sind.
Historisch gesehen hat USP <1058> die Einführung von Geräten der Gruppen A und B in regulierte Labore erleichtert. Die Aktualisierung von 2017 dehnt diesen Vorteil auf einige Geräte der Gruppe C aus.
Jedoch verlangen die Anforderungen von 2017 USP <1058> ein Risikoassessment, mit dem für jedes Gerät eine Kategorie identifiziert werden soll. Dementsprechend müssen Labore die Einordnung Ihrer Geräte in Kategorien rechtfertigen und ihre Verfahren zur konsistenten Kategorisierung basierend auf der Verwendung der Geräte aktualisieren.
Zusammengenommen bedeuten diese Änderungen, dass das 2017 USP <1058> als ein auf den GAMP Good Practice Guide for Laboratory Computerized Systems (ISBN 978-1-936379-49-1) und GAMP 5 (ISBN 1-931879-61-3) abgestimmtes Kontinuum der Qualifizierungsoptionen begriffen werden kann. Im Einzelnen heißt dies:
- USP <1058> ist für Standardgeräte (z. B. HPLC, GC) anzuwenden
- GAMP GPG ist für komplexe Geräte (z. B. QTOF) anzuwenden
- GAMP 5 ist für die Validierung von Individual-Software anzuwenden
Was bedeutet das für Ihr Labor?
Um die Compliance Ihres Labors sicherzustellen, müssen Sie Ihre AIQ an 2017 USP <1058> anpassen. Dies betrifft alle damit verbundenen SOPs und Richtliniendokumente zum AIQ-Lebenszyklus.
Die Agilent CrossLab Compliance-Berater helfen Ihnen gerne bei der Ermittlung von Risiken hinsichtlich der Computersystem-Validierung (CSV) unter Einbeziehung Ihrer Systeme und Ihrer Software.
Data Governance in analytischen Laboren:Grundlage für hohe
Datenintegrität
Qualifizierung und Datenintegrität
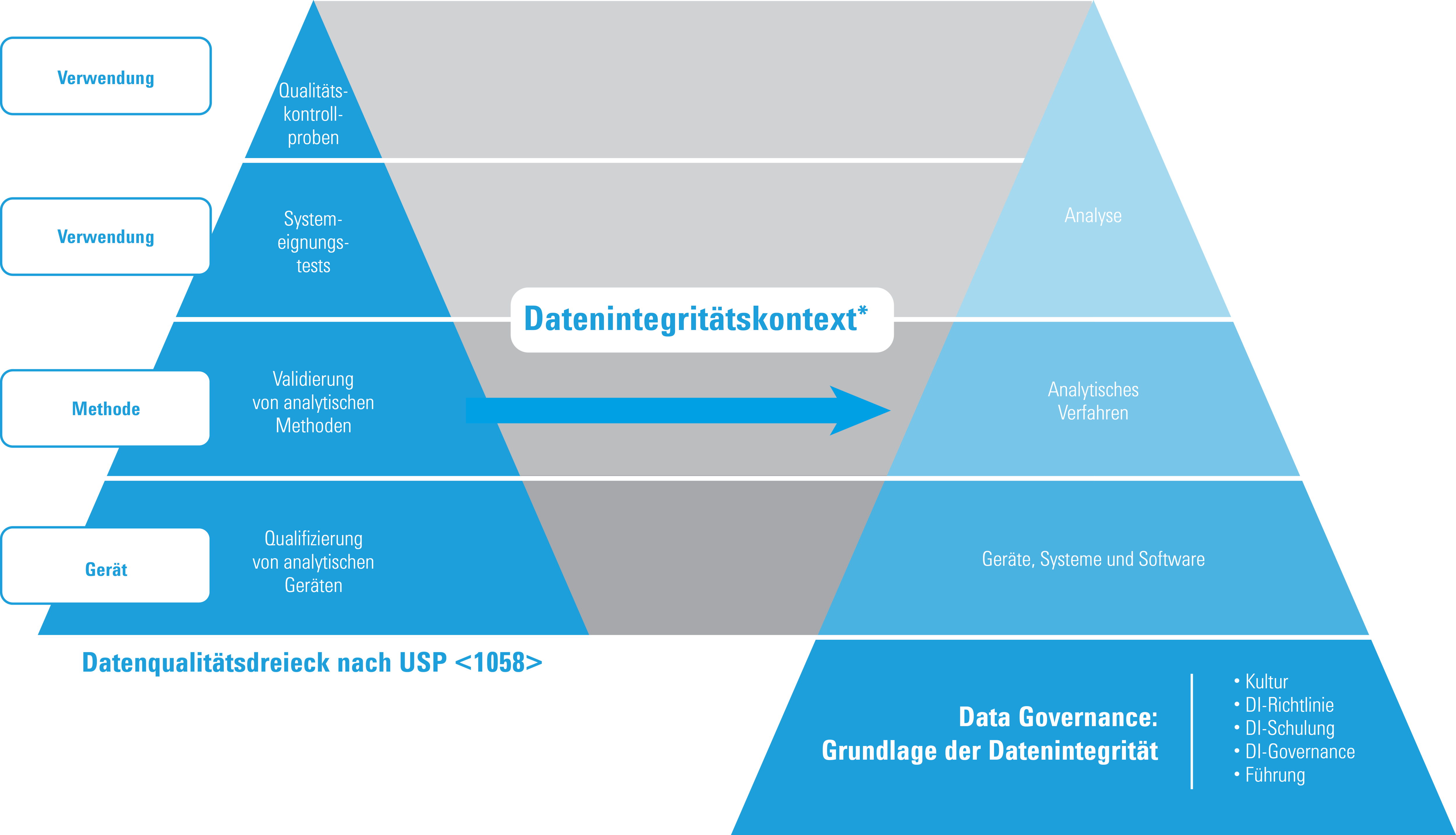
* Nach ISBN 978-1-84973-662-6, mit freundlicher Genehmigung
Die Bedeutung der Datenintegrität
Ergebnisse behördlicher Audits in Bezug auf Datenschutzverletzungen veranlassen die Aufsichtsbehörden weltweit, ein stärkeres Augenmerk auf Datenintegrität zu legen. Eine Zeitlang führte dies dazu, dass weniger auf die herkömmlichen Schwerpunkte bei Audits, wie z. B. AIQ, geachtet wurde. Neuere FDA-Formulare 483 zeigen jedoch, dass die Behörden bei AIQ-Berichten wieder mehr Wert auf Datenintegrität, Rückverfolgbarkeit und technischen Inhalt legen.
Das Datenqualitätsdreieck bleibt in 2017 USP <1058> unverändert. Aus der Perspektive der Datenintegrität hat sich das Dreieck jedoch zu dem hier dargestellten Modell entwickelt. Im Einzelnen heißt das:
- AIQ ist die Grundlage des Datenqualitätsdreiecks von USP <1058>
- Wiederholte Arbeitsgänge oder Analysen müssen gemanagt und erklärt werden (dokumentiert).
- Rückverfolgbarkeit von Daten ist nun eine wichtige Anforderung
- Data Governance ist nun die Grundlage für alle Qualitätsdaten
Was bedeutet das für Ihr Labor?
Probleme mit der Datenintegrität ziehen mehr behördliche Maßnahmen nach sich als bisher. Um Ergebnisse erfolgreich zu vertreten, müssen Sie beweisen können, dass die Daten nicht beeinträchtigt wurden.
Agilent CrossLab Compliance-Berater bieten nicht nur Computersystem-Validierungsservices (CSV) an, sie unterstützen Sie auch bei der Analyse von Datenintegritätslücken und der Methodenvalidierung.