Access Agilent 电子期刊,2014 年 5 月
>> 更新资料 | 订阅 Access Agilent | 文章目录

分析方法的质量源于设计方法 — 最新指导原则
作者:Ravikrishna Chebolu 博士
安捷伦制药部门经理
近几年间,在药物开发和生产中实施质量源于设计 (QbD) 原则已获得极大关注。全球的制药公司现已处于 QbD 实施的不同阶段,虽然许多公司仍在学习 QbD 实施的相关科学技术,但其重要性已被业界广泛接受。
国际协调会议 (ICH) 已经发布了许多指导原则 (ICH Q8-Q11),可帮助研究人员学习 QbD 的原则和实施。2013 年 1 月开始,美国食品药品监督管理局 (U.S. FDA) 强制要求仿制药制造商将 QbD 原理涵盖在 ANDA(简化新药申请)中。有了这项新要求,QbD 的实施就有了更大的推动力。
 放大图片
放大图片
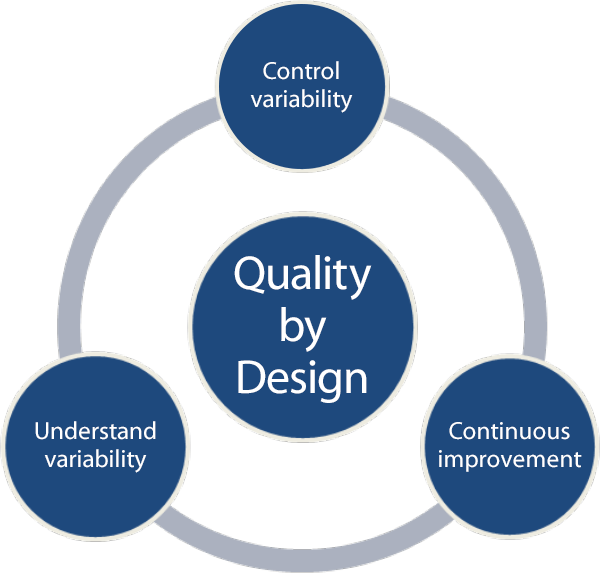
图 1. QbD 实施的关键要素
了解并控制变异性
QbD 实施的基本理念需要您了解变异性的来源,并且要求使用科学和基于风险的方法学控制变异性,并不断进行改进(图 1)。您也可以在逻辑上将此理念应用到药物开发和生产的任何“过程”(化学药品、制剂或其它)中。
许多实验室已开始将 QbD 原则应用到分析方法中,并且使用风险评估和统计学设计的实验来开发稳定的分析方法。类似于在生产过程中使用 QTPP(目标产品质量概况)和设计空间概念的方式,您可以定义分析方法的 ATP(分析目标概况)和 MODR(方法操作设计范围)。
美国药典委员会 (USP) 专家组于 2013 年 7 月针对“分析步骤的生命周期管理”发表了一篇推介文章。该文章建议应将传统的认证、转换和验证方法整合到分析步骤生命周期过程中,而不是将它们看作独立的项目。专家组列出了该方法所具有的一些优势,如更高的透明度、全局性展示和自信的决策等。本文中,ATP 被认为是接近分析步骤的生命周期的一项基本组成,因为它可以帮助您设定这些步骤的性能要求。
作为欧洲药品管理局 (EMA)-FDA试点项目之一 即QbD 应用于一致评估,这些机构就此在 2013 年 8 月联合发布了他们的要求。他们提出“与 ICH Q8 (R2) 中定义的 QTPP 类似,只要分析方法依据了相同的原理, ATP 即可被看作预期方法性能的标杆”。至于 MODR,这些机构表示,“支持 MODR 的示例数据可以包括合适选择的实验方案,以支持推荐的操作范围/条件,以及贯穿整个 MODR 的统计置信度的论证。”
2014 年 2 月,FDA 针对制药行业公布了一项名为“药物和生物制剂的分析步骤和方法认证”的修订指导原则草案,替代之前于 2000 年发布的草案。虽然在该 2014 指导原则草案中没有特别提到“质量源于设计”,但整个文件中使用的术语明确强调了 QbD原则在分析方法开发中的重要性。
最新指导原则草案的重要更新
相比于 2000 年发布的草案,可以很容易找出 2014 指导原则草案的一对重要的更新。“Analytical methods development”(分析方法开发)该节包括推荐“adopt a systematic approach for method robustness study (e.g. design of experiments)”(采用系统的方法进行方法稳定性研究(如,实验的设计)),以及“begin with an initial risk assessment and follow with multivariate experiments”(从最初的风险评估开始,进而进行多变量实验)来了解因子参数对方法性能的影响。新的一节中加入了一段题为“Lifecycle management of analytical methods”(分析方法的生命周期管理)的新内容。为了在确保产品质量的过程中获得更高的置信度,此段内容根据更好地了解产品关键质量属性 (CQA) 的最新信息(在新技术的辅助下),论述了一项对分析方法进行持续改进的措施。
ICH 于 2013 年发布的“Q3D 元素杂质指导原则”与此有关,它针对元素杂质推荐了一个四步骤的程序(鉴定、分析、评价和控制)。控制步骤要求生产商检验最终产品,以查明任何可能在生产或包装过程中产生的杂质。
总之,仔细揣摩监管部门最近发布的用于分析方法开发和认证的指导原则,我们会发现它更加强调 QbD 原则,如,通过了解和消除变异性,利用基于科学和风险的系统化方法实现稳定分析方法的开发。更重要的是,作为生命周期管理的一部分,该指导原则鼓励使用新技术对分析方法的适用性进行持续评价(图 2)。
辅助 QbD 实施的安捷伦解决方案
安捷伦提供有多款工具(见图 3)来帮助您设定稳定分析方法开发的设计空间,消除方法转换的变异性,并对原料药和药品的 CQA 进行评价。您可以联用 Agilent 1200 Infinity 系列方法开发解决方案和 QbD 软件,使开发过程自动化,并方便地进行多变量实验来表征方法的设计空间。在我们最近出版的基础导论 (5991-2166CHCN) 中,可找到支持 QbD 实施的安捷伦解决方案的更多信息。
注:本文所表达的理念和观点不代表官方的公司政策。我们建议读者咨询官方监管网站及其它可靠来源,以获取最新信息。
>> 更新资料 | 订阅 Access Agilent | 文章目录