Гарантия целостности данных для квалификации аналитических приборов

Услуги по обеспечению соответствия Agilent CrossLab сводят к минимуму риск несоответствия нормативным требованиям
Все лаборатории, работа которых регулируется законодательством, как фармацевтические, так и другие, должны документально подтверждать пригодность своих аналитических приборов для их целевого использования. Для выполнения этих требований лаборатории должны регулярно проводить квалификацию аналитических приборов (AIQ).
Фармакопея США — это единственная из основных мировых фармакопей, которая содержит общую фармакопейную статью, посвященную квалификации аналитических приборов — статью <1058>. Таким образом, изменения в этой <1058> статье имеют общемировое значение. Статья <1058> фармакопеи США в редакции от 1 августа 2017 г. вступила в силу с первого августа 2017 г. и это может иметь серьезные последствия для вашей лаборатории.
Компания Agilent может помочь вам внедрить в вашей лаборатории недорогую процедуру квалификации и привести ваши регламенты в соответствие с требованиями статьи <1058> фармакопеи США в редакции 2017 г. за счет целостного подхода к квалификации на протяжении всего времени службы оборудования.
Что вы должны знать про статью <1058> фармакопеи США в редакции 2017 г.
Целостный подход к квалификации на протяжении всего срока службы оборудования в соответствии с требованиями статьи <1058> в редакции 2017 г. —лучший способ защитить вашу лабораторию во время аудита
Целостный подход к квалификации оборудования
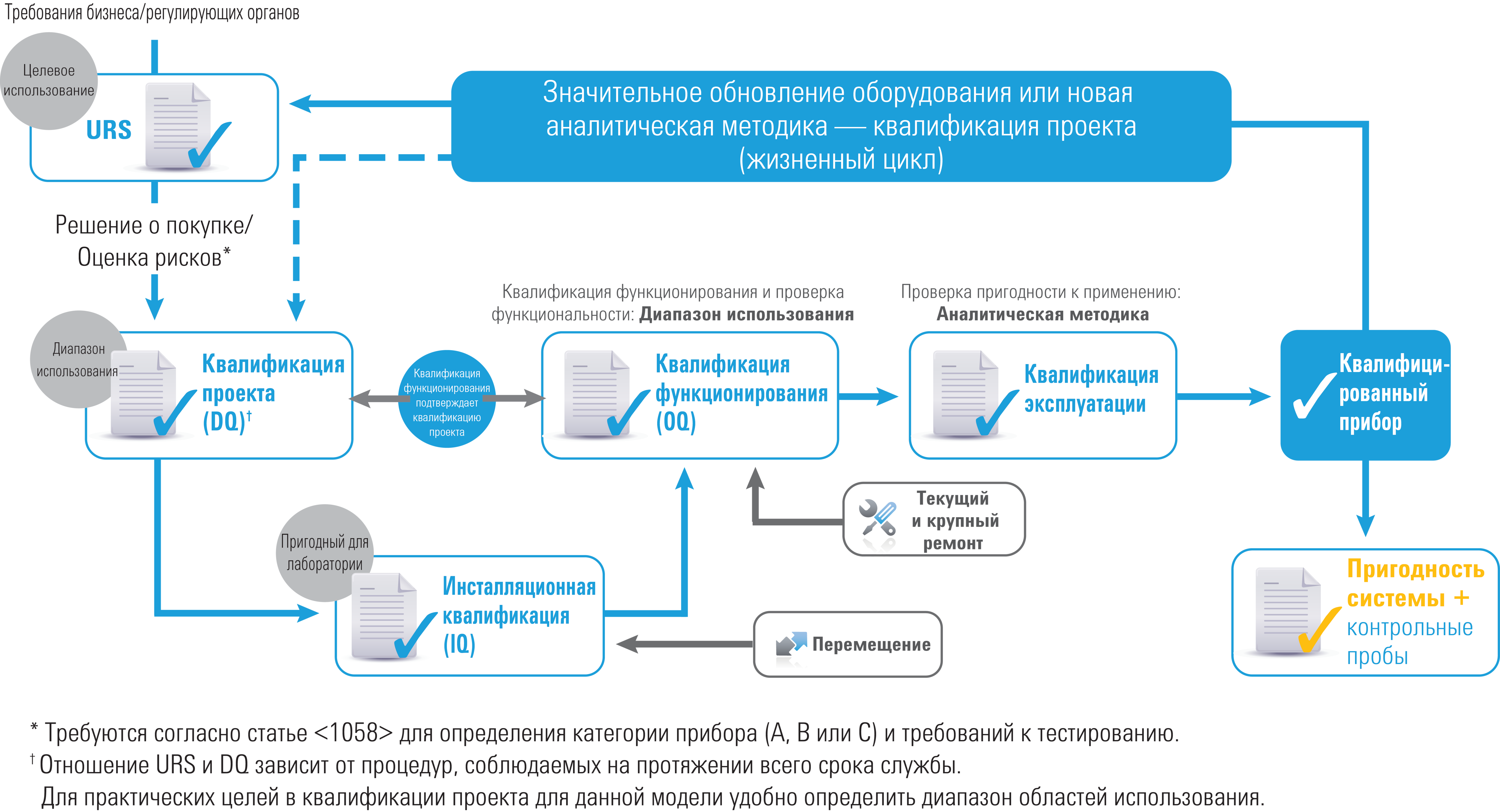
Квалификация оборудования на протяжении всего срока службы
Статья <1058> в редакции 2017 г. отражает изменения в подходах к квалификации аналитического оборудования, которые позволяют отслеживать квалификационные данные на протяжении всего срока службы прибора. Некоторые нормы не изменились. Это включает в себя
- деление аналитического оборудования на группы А, В и С (хотя некоторые примеры и исчезли),
- модель четырех квалификаций (4Q): квалификация проекта (DQ), инсталляционная квалификация (IQ), квалификация функционирования (OQ) и квалификация эксплуатации (PQ).
Однако по сравнению с предыдущей редакцией значения всех этих четырех квалификаций и их связи между собой объяснены значительно лучше. Кроме того значительно была значительно расширена секция, посвященная программному обеспечению.
Основные изменения включают в себя:
- URS: обязательно наличие спецификации целевого использования (URS);
- OQ: квалификация функционирования теперь связана с URS/DQ
- OQ: обязательно наличие квалификации функционирования (функциональность и диапазон использования);
- PQ: обязательно наличие квалификации эксплуатации (целевое использование/область использования);
- DQ, OQ и PQ: квалификация проекта, квалификация функционирования и квалификация эксплуатации теперь динамично связаны с областью использования прибора.
Что это значит для вашей лаборатории?
Существующие процедуры и политики, связанные с жизненным циклом аналитического оборудования, могут не полностью соответствовать требованиям статьи <1058> в редакции 2017 г. и требовать обновления.
Консультанты по обеспечению соответствия программы Agilent CrossLab помогут вам внедрить процедуры квалификации, соответствующие требованиям обновленной в 2017 г. статьи <1058> фармакопеи США.
Целостный подход к валидации ПО и квалификации оборудования:соответствие требованиям статьи <1058> фармакопеи США и надлежащей автоматизированной производственной практики;®
постоянный процесс квалификации.

* Требование включать в квалификацию на протяжении всего срока службы прибора соответствующую матрицу прослеживаемости требований зависит от целевого использования, сложности прибора и политик компании. GAMP (надлежащая автоматизированная производственная практика) является зарегистрированной торговой маркой ISPE (международное общество по технической фармации). Публикации, посвященные GAMP, на сайте ISPE: www.ispe.org/publications/guidance-documents
Целостный подход к квалификации оборудования и валидации ПО
Значительное расширение требований к ПО, а также отсутствие примеров деления оборудования на группы А, В и С значит, что статья <1058> теперь лучше соответствует GAMP® 5.
Ранее статья <1058> упростила процесс внедрения в регулируемых лабораториях приборов групп А и В. Обновление 2017 года сделало то же самое для приборов группы С.
Однако статья <1058> в редакции 2017 г. требуют проведения оценки рисков для деления оборудования на группы. В соответствии с этими требованиями лаборатории должны мотивировать отнесение прибора к соответствующей группе и обновить свои процедуры, чтобы однозначно определить критерии деления оборудования на группы в зависимости от его целевого использования.
Все это значит, что предлагаемые в статье <1058> в редакции 2017 г. варианты квалификации теперь соответствуют требованиям руководства GAMP по надлежащей практике (GPG) для лабораторных компьютеризированных систем (ISBN 978-1-936379-49-1) и GAMP 5 (ISBN 1-931879-61-3). В частности:
- для стандартных приборов (например ВЭЖХ, ГХ) используйте USP <1058>;
- для сложных приборов (например QTOF) используйте GAMP GPG;
- для валидации ПО Bespoke используйте GAMP 5.
Что это значит для вашей лаборатории?
Чтобы соответствовать нормативным требованиям вы должны привести свои процедуры квалификации в соответствие с требованиями статьи <1058> фармакопеи США в редакции 2017 г. Это включает в себя все связанные с этим технологические регламенты и документацию по политикам квалификации аналитического оборудования на протяжении всего срока службы.
Консультанты по соответствию программы Agilent CrossLab готовы предложить вам свою помощь, чтобы оценить ваши риски валидации компьютерных систем (CSV) и провести валидацию ваших систем и ПО.
Управление данными в аналитических лабораториях —основа надежной
целостности данных
Квалификация и целостность данных
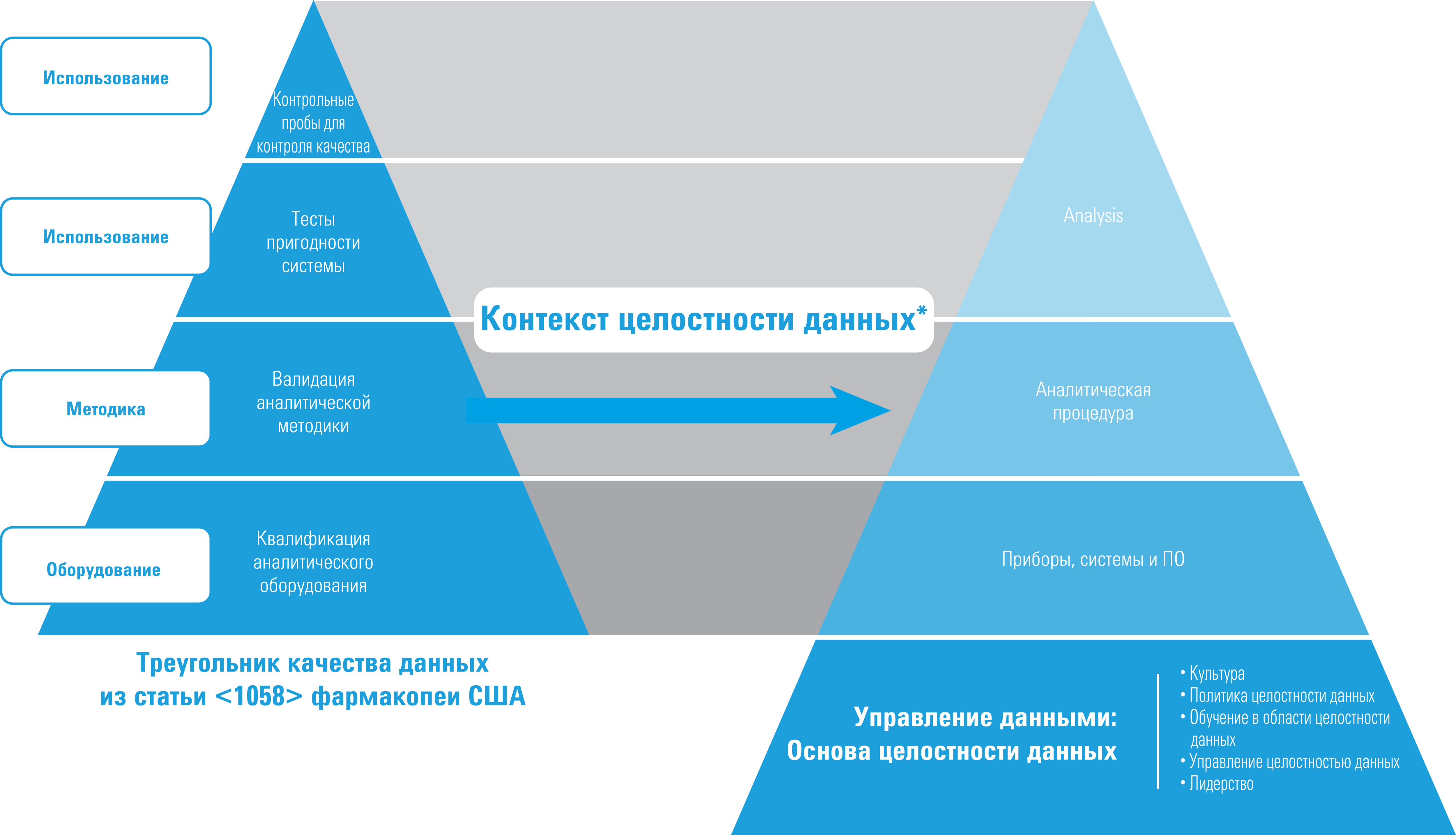
* Цитируется с сокращениями по разрешению правообладателя из ISBN 978-1-84973-662-6
Значение целостности данных
Обнаруживаемые во время аудитов проблемы, связанные с нарушением целостности данных, заставляют регулирующие органы всего мира обращать на это все больше внимания. Раньше это значило, что меньше внимания уделялось традиционным направлениям, таким, как квалификация аналитических приборов. Однако последние формы FDA 483s позволяют заметить, что регулирующие органы снова начинают обращать детальное внимание на целостность данных, прослеживаемость и техническое содержание отчетов о квалификации.
В статье <1058> в редакции 2017 г. треугольник качества данных не изменился, однако, с точки зрения целостности данных, он эволюционировал. В частности:
- квалификация теперь является основанием треугольника качества данных статьи <1058>;
- непрохождение квалификации с первого раза должно объясняться, документироваться, а его причины устраняться;
- прослеживаемость данных теперь — одно из основных требований;
- управление данными теперь — основа качества данных.
Что это значит для вашей лаборатории?
Проблемы с целостностью данных теперь скорее, чем раньше, приведут к принятию мер со стороны регулирующего органа. Чтобы успешно защитить свои результаты вы должны быть готовы доказать, что ваши данные не были повреждены или изменены.
Кроме проведения валидации компьютерных систем консультанты по соответствию программы Agilent CrossLab помогут вам найти пробелы в целостности данных и валидации методик.