根据世界卫生组织的数据,约五分之一的人在其一生中会罹患癌症1。令人担忧的是,死亡率数据显示,约九分之一的男性和十二分之一的女性死于癌症1。
自 18 世纪末以来,癌症研究及相关领域的重大发现不断涌现,增进了我们对癌症的理解,并推动了对现代方法辅助抗癌的探索2。
过去十年间,重大研究突破主要集中在癌症遗传学、抗癌药物与疫苗研发以及免疫疗法三大领域。
在本文中,安捷伦转化研究部门总监 Mark Garner 博士将解析癌性肿瘤在患者体内的形成机制,以及研究与医学领域如何通过不断进步来对抗癌症。
癌症是一种突变性疾病
癌症的发生源于一个或多个基因的突变,这些突变破坏了细胞的调控机制,直接或间接导致细胞增殖失控 — 这正是所有癌症的标志性特征。这类突变被称为“司机突变”,以区别于癌细胞积累的大量其他突变,即所谓的“乘客突变”。
20 世纪 70 年代,随着致癌基因的发现,癌症的突变基础得以确立。致癌基因是指突变时会驱动癌症发生的基因,首个致癌基因是在劳斯肉瘤病毒(一种导致鸟类患癌的病毒)中发现的3。在发现导致鸟类患癌的病毒基因 (src) 后,Varmus 和 Bishop 进一步证实,他们研究的几乎所有鸟类物种体内都天然存在与 src 类似的基因。这一发现表明,致癌基因是细胞基因组的正常组成部分,其突变会破坏细胞内精细平衡的稳态调控机制3。

识别肿瘤中存在的突变或其他基因组异常,是癌症诊断的核心环节。分子肿瘤委员会 (Molecular Tumor Boards, MTBs) 由癌症基因组学专家及其他专科医生组成,他们通过整合患者肿瘤的基因组与分子数据及临床观察结果,为患者的肿瘤医师推荐可能的治疗方案。
如今,MTBs 现已被众多癌症中心列为标准诊疗模式,完美诠释了“精准肿瘤学”理念 — 即根据肿瘤的分子表型而非原发部位来制定治疗方案。
精准肿瘤学从根本上改变了研究人员和临床医生应对癌症的方式。精准肿瘤学的理念和前景均在于靶向治疗,尤其是基于对患者肿瘤进行详细分子表征的疗法,相较于传统化疗,有望实现更高疗效并显著降低毒副作用。
除基因疗法外,多数癌症治疗并非直接靶向特定基因,而是作用于基因的蛋白质产物、信号通路中的其他蛋白质,甚至因肿瘤突变而大量改变的小分子代谢物。因此,确定癌症治疗的有效分子靶点,往往是研究人员和临床医生面临的关键挑战。
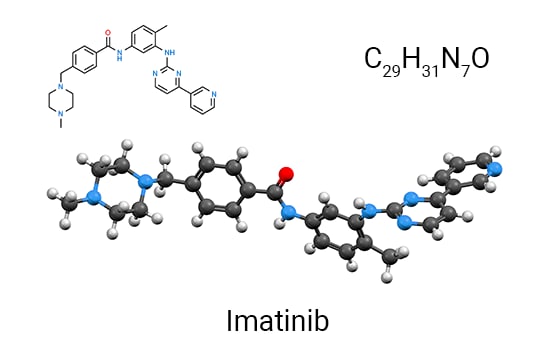
这一“基因-蛋白-药物”范式的经典例证,便是针对慢性髓性白血病 (CML) 研发的靶向药物“格列卫” (Gleevec)。在格列卫问世前,仅 30% 的 CML 患者在确诊后能存活 5 年4。
早在 20 世纪 60 年代初,研究者就注意到大多数 CML 患者的 22 号染色体(即“费城染色体”)异常缩短。最初,研究者推测这是染色体末端缺失所致。但在 1973 年,Janet Rowley 通过细致的显微镜观察发现,22 号染色体缺失的片段实际上是发生了易位 — 这段“消失”的片段被转移到了 9 号染色体的末端5。
随着分子技术的普及应用,相关研究进展显著加快。染色体易位所预测的 DNA 重组现象最终获得了实验验证。观察发现,在重组/易位过程中,9 号染色体上的 abl 基因偶然与 22 号染色体末端的 bcr 基因片段融合,形成新的基因:bcr-abl(如图 1 所示)。
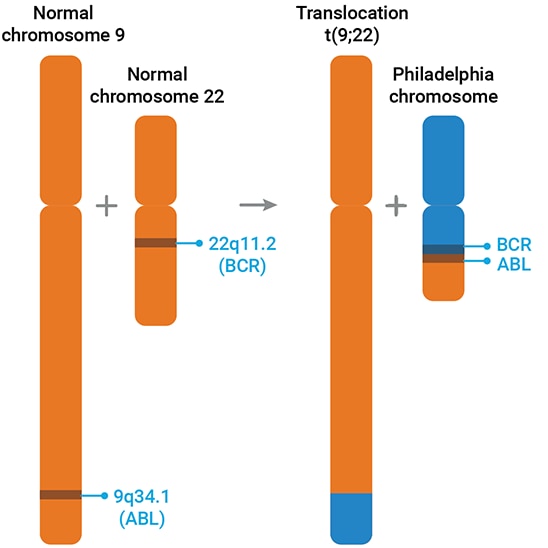
abl 基因与 src 基因的细胞类似物相似,并编码一种酪氨酸激酶蛋白。与其他激酶类似,该蛋白作为复杂信号通路的组成部分,参与调控细胞分裂等多种生理过程。bcr 片段与 abl 的融合破坏了这种自我调控机制,导致 bcr-abl 酪氨酸激酶过度活跃,进而破坏细胞控制,引发 CML。
Brian Drucker 博士和 Nicholas Lyndon 博士致力于筛选能抑制 bcr-abl 活性但不影响正常细胞功能的化合物。一种名为 STI-571(格列卫)的潜力化合物成功进入 I 期临床试验阶段。Druker 博士在接受《纽约时报》采访时回忆:“在临床试验中,我们见证了奇迹 — 当患者接受有效剂量治疗后,缓解率达到了 100%6。”最终,格列卫获得美国 FDA 批准,自此每年挽救数千条生命,包括其他 9 种由同类激酶驱动的癌症患者。
然而,有效抗癌药物的研发并非一路坦途。例如,2023 年美国癌症研究协会年会 (AACR 2023) 的全体会议以“攻克 KRAS:三十年磨一剑的突破”(Beating KRAS: A 30-Year Overnight Sensation) 为题,以此纪念从发现 K-RAS 人类致癌基因到实现临床靶向治疗这段漫长而艰辛的科研历程7。
免疫系统与癌症:既是猎手与猎物的博弈,亦蕴含偶然与必然的辩证
癌症免疫疗法的设计初衷,是增强患者自身免疫系统对癌细胞的“猎杀”能力。该疗法基于免疫监视理论 — 作为哺乳动物免疫系统的基本功能,先天免疫系统的自然杀伤细胞(NK 细胞)和巨噬细胞会与适应性 T 细胞协同作用,在肿瘤形成前的早期阶段主动识别并清除癌细胞。
然而,癌症免疫疗法的靶标是一种难以捉摸的“猎物”,它能够改变自身微环境以隐藏甚至破坏免疫系统。当然,癌细胞与免疫细胞既不会“思考”,也不存在主观意图。实际上,癌细胞携带着其演化过程中积累的所有基因突变,在快速分裂增殖的同时,还会不断产生更多随机突变。这些突变不仅驱动着癌细胞的代谢活动与相互作用,更会主动重塑周围微环境以逃避免疫系统的监视。
分子生物学奠基人之一 Jacques Monod 曾深入思考这一对矛盾:随机突变过程与看似为逃避免疫系统而发生的“主动适应性改变”理论之间的辩证关系。在其哲学著作《偶然与必然》(Chance and Necessity) 中,Monod 阐释道:连接二者的媒介正是“自然选择”— 这一机制会淘汰绝大多数发生中性或无害突变的生物体8。
例如,若将氨苄青霉素敏感型大肠杆菌接种于含氨苄青霉素的常规 LB 琼脂平板,不会有任何菌落生长。但如果将同一菌液进行几轮培养后再重复接种,最终会有部分氨苄青霉素耐药菌落出现。这些耐药菌并非“预先准备”好的,本质上是敏感菌通过随机突变获得耐药性(偶然性),而平板上抗生素的选择压力(必然性)共同作用的结果。自然选择作为中介者,“筛选”出了这些幸运的极少数突变菌株。这一过程虽看似生物体“主动”获得特性的选择,实则完全基于随机选择机制。
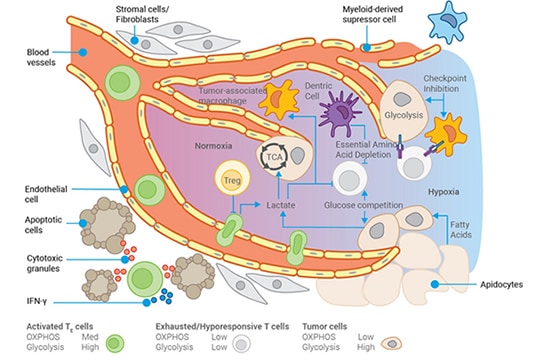
在肿瘤中,类似的过程持续上演。 癌细胞不断积累突变的一个必然结果,是其细胞代谢机制发生紊乱,这种紊乱恰恰为肿瘤细胞快速增殖提供了必要的大分子前体物质。更具颠覆性的是,肿瘤细胞能够利用几乎任何碳源进行代谢供能,甚至通过降解 RNA 来获取能量底物。这些变化会影响肿瘤周围的细胞外环境,即肿瘤微环境 (TME)。
肿瘤细胞可能会消耗 TME 中几乎所有的葡萄糖,迫使浸润性 T 细胞依赖脂质作为燃料。而脂质的类型不同,可能会削弱其抗肿瘤活性。由于血管生成不足难以支撑肿瘤的快速生长,TME 往往呈现酸性增强、氧分压降低的特征。
这种环境堪比“毒性垃圾场”,会严重削弱免疫系统定位和清除肿瘤细胞的能力,几乎像是肿瘤细胞通过改造微环境形成了某种“自我保护本能”。
此外,与正常细胞一样,肿瘤会招募成纤维细胞分泌胶原蛋白并形成异常的细胞外基质,但癌细胞也会构建自己的基质。矛盾的是,尽管肿瘤微环境中充斥着免疫细胞,这些细胞的“猎杀”功能却显著减弱甚至完全丧失。最终,本应被清除的癌细胞就这样在免疫系统的“眼皮底下”继续存活。
靶向出击,精准命中

T 细胞通过识别细胞表面呈递的肽片段(抗原)来判定细胞是否为癌细胞。在发育过程中,T 细胞会学习识别来自人体所有“自身”蛋白质的抗原。当 T 细胞遇到一种之前未被识别的抗原(“新抗原”)的细胞时,它会将其识别为外来物、癌细胞或被感染的细胞(这一机制同样用于识别病毒感染细胞),并启动细胞杀伤程序。
近年来,研究人员逐渐认识到:肿瘤突变负荷越高,向免疫系统呈递的新抗原可能越多。有时,肿瘤突变负荷较高的患者对免疫疗法的反应优于突变负荷较低的患者。这一现象的解释是:突变数量越多,新抗原数量也越多,随机 T 细胞识别其中一个新抗原并靶向肿瘤细胞的概率就越高。这个必然的隐喻在于:免疫系统获得了“更多精准打击机会”,从而更有可能彻底清除癌细胞。
2020 年,美国 FDA 批准抗 PD-1 药物帕博利珠单抗 (Keytruda) 用于治疗任何突变负荷高于每兆碱基 10 个突变的实体瘤。 后续研究对“单一临界值是否适用于所有肿瘤类型”提出了质疑,但“高突变负荷肿瘤更易受免疫系统攻击”这一核心原则已然明确。更有研究者提出颠覆性设想:通过人为诱导肿瘤增加突变,使其更易被免疫系统识别清除。尽管这一激进疗法尚存争议,我们正在掌握如何安全有效地“化敌为盾”— 利用致癌突变本身来摧毁肿瘤。正如《孙子兵法》所言:“不可胜在己,可胜在敌”10。
关于 Mark Garner 博士

Mark Garner 于密歇根州立大学获得生物化学博士学位。在研究生阶段,他发明了如今全球广泛使用的凝胶迁移(或称为“EMSA”)实验,用于研究蛋白质与 DNA 的相互作用。此后,他先后担任美国癌症协会博士后研究员、美国国立卫生研究院 (NIH) 国家研究服务奖获得者,并在威斯康星大学麦迪逊分校从事第二个博士后研究。在此期间,Mark 还与位于哥廷根的马克斯·普朗克生物物理化学研究所建立了长期合作关系。回到 NIH 后,他主导了核酸毛细管电泳、大分子拥挤效应及其对细胞过程影响的分子生物物理学基础研究。进入企业界后,他始终是多家前沿科技公司的核心成员。2006 年,Mark 移居加拿大多伦多并定居至今,2020 年初加入安捷伦科技公司,现任转化研究市场总监。
参考文献
1 Global cancer burden growing, amidst mounting need for services (who.int) 2 Milestones in Cancer Research and Discovery - NCI 3 Varmus, H.E. Viruses, genes, and cancer. I. The discovery of cellular oncogenes and their role in neoplasia. Cancer 55, 2234-2238 (1985) 4 Pray, L. (2008) Gleevec: the Breakthrough in Cancer Treatment. Nature Education 1(1):37 5 ROWLEY, J. A New Consistent Chromosomal Abnormality in Chronic Myelogenous Leukaemia identified by Quinacrine Fluorescence and Giemsa Staining. Nature 243, 290–293 (1973). 6 Researcher Behind the Drug Gleevec - The New York Times (nytimes.com) 7 AACR Annual Meeting 2023: Beating KRAS - American Association for Cancer Research (AACR) 8 Monod, Jacques. Chance and necessity : an essay on the natural philosophy of modern biology. London, Penguin, 1997. 9 Marcus et al FDA Approval Summary: Pembrolizumab for the treatment of tumor mutational burden-high solid tumors Clin Cancer Res 27, 4685-4689 (2021) 10 Tzu, Sun. The Art of War. United States, Shambhala, 2019.