Access Agilent 电子期刊(2015 年 5 月)
>> 更新资料 | 订阅 Access Agilent | 文章目录

使用安捷伦集成系统研究物种特异性毒性
作者:Patrick D. McMullen 和 Melvin E. Andersen
哈姆纳健康科学研究院
及 Mary T. McBride
安捷伦政府关系总监
生物暴露于环境化学物质中通常会导致多种生理结果,而这些结果在人类和啮齿动物之间有一定的差异,因此产生了基于动物的毒理学测试结果是否能应用于人类风险评估的疑问。例如,过氧化物酶体增殖物(包括内源性脂肪酸和药物)可诱导人体内脂肪酸的代谢。因此,过氧化物酶体增殖物活化受体被用作血脂异常(血液中脂质含量异常)和糖尿病的治疗靶点。在啮齿动物中,过氧化物酶体增殖物除了可调节脂肪酸代谢之外,还可影响过氧化物酶体的装配、炎症反应和细胞增殖。多种过氧化物酶体增殖物对于啮齿动物来说都是强致癌物质,而它们对于人类并不具有致癌性 [1-3]。上述差异映证了在不同物种间进行毒理学研究的转化以及深入了解造成这些差异的根本原因的必要性。过氧化物酶体增殖物活化受体 (PPAR) 是一种具有转录因子功能的核受体。本文对一系列设计用于进一步了解 PPAR-α (PPARα) 在分子水平上的物种特异性差异的实验进行了深入探讨。[4]
 放大图片
放大图片
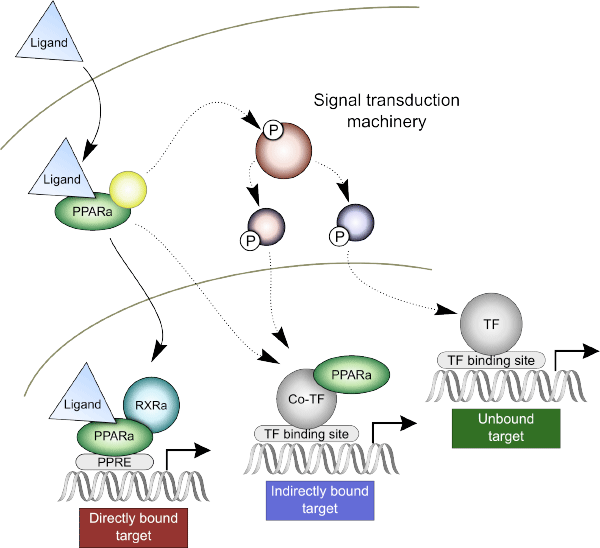
图 1. 我们的结果揭示了 PPARα 介导响应的典型机制以及其他两个结合机制。
结合数据流绘制 PPARα 网络图
首先,我们结合使用高通量基因表达、ChIP 测序和代谢组学实验来表征人类和啮齿动物的原代肝细胞对 PPARα 选择性激动剂 GW7647 的响应。在多个不同的浓度和时间点测定了基因表达量。我们在大鼠肝细胞中发现了显著多于人类肝细胞的差异表达基因,前者达到了 2713,而后者仅为 192。虽然 GW7647 诱导的脂质代谢转录过程在两个物种间都非常保守,但是在大鼠中大量基因的表达发生了下调,而人类的这些基因表达差异并不明显。这些表达下调的基因中包括一系列控制发育过程的基因,这也解释了为何过氧化物酶体增值物对啮齿动物的毒性更大。
在关键时间点和剂量点进行 ChIP 测序实验以评价 PPARα 的基因组结合。结合计算模体搜索分析这些数据的结果显示,典型的核受体反应机制(即直接结合)只能解释我们检测到的一小部分响应(大鼠中的 24% 基因,人类中的 32% 基因)。这表明非直接 PPARα 转录机制比我们此前所认为的占有更大的比例。图 1 展示了活化 PPARα 与已知的一致性结合位点(过氧化物酶体增殖物反应元件 (PPRE)) 直接结合的过程。但是,该机制也只能解释我们所观察到的 30% 的基因表达变化。我们的结果支持两个附加的机制:非直接基因组结合和非结合非基因组相互作用。
 放大图片
放大图片
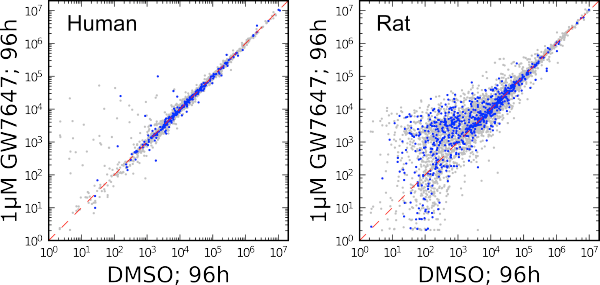
图 2. 原代人类肝细胞培养物(左图)和原代大鼠肝细胞培养物(右图)分泌蛋白组的代谢组学特征比较。
正交数据有助于实现深入了解
为了评价 PPARα 活化所导致的代谢组学变化,我们采用非靶标代谢组学方法进行了液相色谱高分辨率质谱 (LC-HRMS) 分析。分别培养大鼠和人类原代肝细胞,并使用 GW7647 处理,然后在多个时间/剂量点分析分泌蛋白组。采用通过电喷雾接口 (ESI) 与 Agilent 1290 Infinity 液相色谱连接的 Agilent 6500 系列精确质量数四极杆飞行时间 (Q-TOF) LC/MS 系统分析样品。为了最大化检测范围,采用了两种正交的 UPLC 分离方法,分别使用正相 HILIC 和 Agilent ZORBAX Plus C8 反相色谱柱。
GW7647 引发的肝细胞活化会导致脂肪酸代谢发生大规模变化,还会使过氧化物酶体大量增加。与人类肝细胞相比,大鼠肝细胞发生的特征变化更多(图 2)。虽然能够明确鉴定和确证代谢物的进一步分析还在进行中,之前鉴定出的多种代谢物已经能够归为几个类别的生物活性化合物。其中包括蜥蜴胆酸、胆汁酸以及含有缩醛磷脂的双甘油酯和单甘油酯 [2]。在图 2 中,两种细胞培养物中均加入了浓度为 1 mM 的 PPARα 特异性激动剂 GW 7647,并在处理 96 小时之后对样品进行分析。蓝色标记指示出了根据人类代谢物组数据库本体论推断为脂质的特征。
安捷伦集成毒理学解决方案
安捷伦为集成的多组学探索研究提供一整套卓越的分析平台,其中包括基因组学、代谢组学和蛋白质组学解决方案。查看全部可选项目,在您的研究中充分利用集成的系统毒理学方法带来的优势。欢迎查看我们专为生物通路多组学数据的整合而设计的最新版 GeneSpring 生物信息学软件。
参考文献
- Bentley, P. et al. Food Chem. Toxicol. 31, 857-907 (1993).
- Cattley, R. et al. Regul. Toxicol. Pharmacol. 27, 47-60 (1998).
- Corton, J. C. et al. Crit. Rev. Toxicol. 44, 1-49 (2014).
- McMullen, P. et al. Chem.-Biol. Interact. 209, 14-24 (2014).
仅限研究使用。不可用于诊断目的。
>> 更新资料 | 订阅 Access Agilent | 文章目录