Access Agilent 电子期刊(2015 年 5 月)
>> 更新资料 | 订阅 Access Agilent | 文章目录

咨询专家:生物仿制药表征的第一步是什么?
作者:Koen Sandra
比利时色谱研究所
以及 Maureen Joseph
安捷伦生物制药应用部
衍生自生物药物,如单克隆抗体 (mAb) 的治疗方法为许多患者的生活带来了极大改变,而且这种新型治疗方法具有无限的治疗潜力,即使对于某些非常棘手的疾病也不例外。在一系列新的文章中,我们的专家以赫塞汀的方案为例,探讨了开发有效生物仿制药的必要步骤。文中所涉及的技术与开发和评估创新药物所用的技术并无太大区别。
这篇介绍性的文章着眼于采用亲和色谱进行 mAb 生物仿制药表征的第一步,随后的文章则介绍了完整 mAb、mAb 碎片、多糖、电荷异构体以及聚集体的反相液相色谱分析。最后一篇文章将为您介绍一些功能强大的软件工具,它们将帮助您成功开发出生物仿制药。此外,您还可以参阅我们的免费电子书《制备生物仿制药》,其中包括了上述所有文章的详细内容。
问题:什么是 mAb?
回答:mAb 是一种糖基化大分子,其能够通过与特定物质(抗原)结合破坏该物质(抗原)的功能,进而触发对靶细胞的免疫应答。mAb 是一类数量不断增长的治疗药物,经认证的 mAb 药物种类也在不断增多。许多 mAb 现在已经或正在作为“仿制药”被推向市场,它们广受追捧并成为了畅销药物,同时也引发了人们对于生物仿制药的极大关注。这类生物大分子非常复杂,并且它们对于制造过程中的各种变化极为敏感,因此,能够完全表征及比较生物仿制药和原研药的先进技术成为日益迫切的需要。
问题:哪种技术最适合用于分析复杂的 mAb?
回答:色谱和质谱是分析 mAb 的强大分析工具。我们通常采用反相液相色谱 (RPLC) 和液质联用系统 (LC/MS) 来研究 mAb 的一级结构和翻译后修饰,采用体积排阻色谱 (SEC) 来分析聚集体,采用离子交换色谱 (IEX) 来检测电荷异构体。而对于糖基化分析,亲水相互作用色谱 (HILIC) 则是最佳选择。
在使用这些分析技术之前,我们首先需要将通过重组方式生成的 mAb 从细胞培养物的上清液中分离出来。通常采用亲和色谱进行分离,例如使用 Agilent Bio-Monolith Protein A 色谱柱。
问题:为什么亲和色谱如此重要?
回答:在分析级研究中,亲和色谱可用于单克隆抗体的早期开发,因为它能够进行高通量的 mAb 滴度测定并且能够直接从细胞培养物上清液中获取 mAb。亲和色谱还能够进行生物相似性的早期评估以及样品的 µg 级纯化,以便我们采用质谱 (MS) 或其他色谱技术(例如 RPLC、SEC 和 IEX)对样品进行进一步分析。
问题:如何确定不同克隆体的 mAb 滴度?
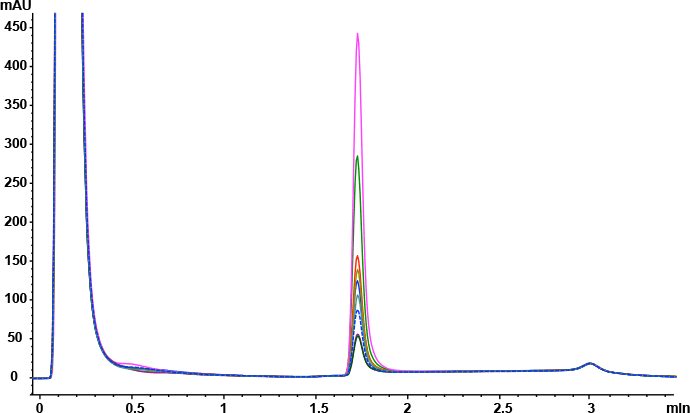
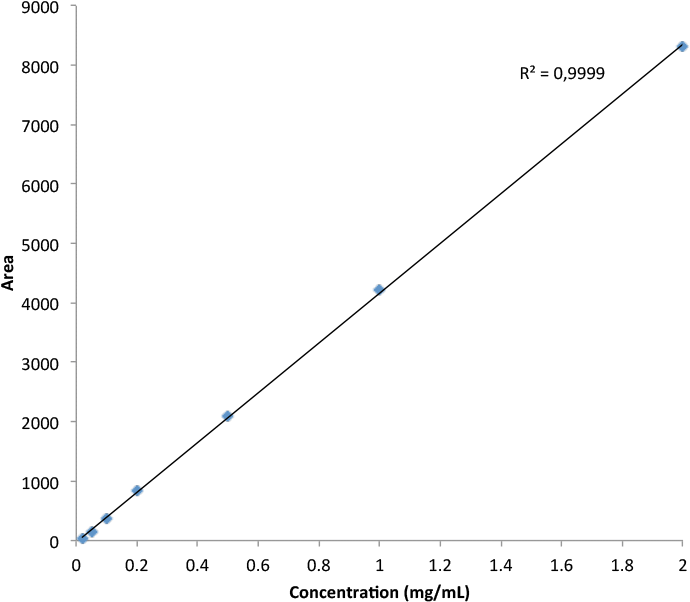
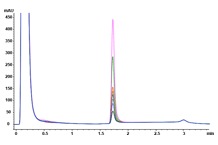
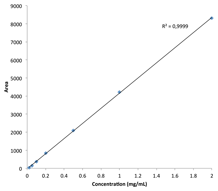
回答:Agilent Bio-Monolith Protein A 色谱柱具备测定细胞培养物上清液中的 mAb 滴度所需的全部特性。它能在预期的 mAb 浓度范围内实现快速、准确且线性的测定。图 1 展示了采用 Agilent Bio-Monolith Protein A 色谱柱分析九种曲妥珠单抗产生的 CHO 克隆体的结果。测定 mAb 滴度时可采用使用赫塞汀原研药建立的校准曲线(图 2)。绝对 mAb 浓度如表 1 所示。
CHO 克隆体 |
浓度 (mg/mL) |
|---|---|
3 |
0.210 |
8 |
0.256 |
9 |
0.494 |
10 |
0.757 |
24 |
0.262 |
25 |
0.098 |
26 |
0.090 |
28 |
0.173 |
32 |
0.144 |
表 1. 实验测得的曲妥珠单抗产生的不同 CHO 克隆体的绝对 mAb 浓度
 放大图片
放大图片
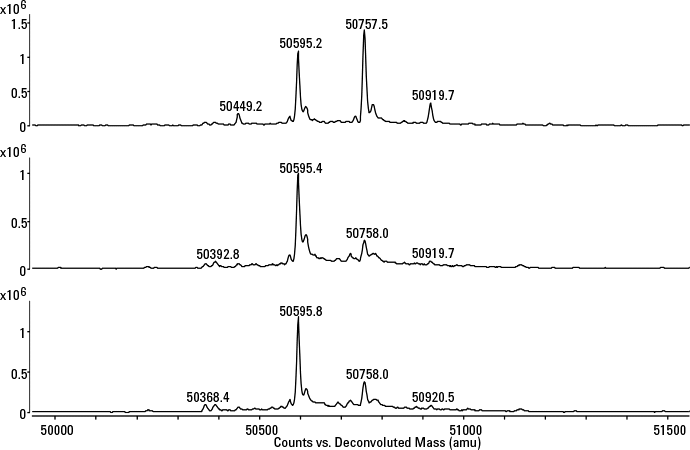
图 3. 赫塞汀原研药和曲妥珠单抗产生的两种克隆体的解卷积重链谱图。G0、G0F、G1F 和 G2F 表示连接到 mAb 上的 N-糖链
 放大图片
放大图片
图 1. 曲妥珠单抗产生的九种 CHO 细胞克隆体的 Agilent Bio-Monolith Protein A 叠加谱图,分析时使用柠檬酸作为洗脱缓冲液
 放大图片
放大图片
图 2. 采用 Agilent Bio-Monolith Protein A 色谱柱获得的赫塞汀校准曲线(0.02 至 2 mg/mL)
问题:如何比较生物仿制药和原研药分子?
回答:首先分析优选克隆体(尤其是高滴度克隆体)的结构特征,然后将其与原研药分子进行比较。我们收集 Protein A 馏分,对其二硫键进行还原,产生轻链和重链,然后使用高分辨率质谱进行分析。这一策略能够验证氨基酸序列并揭示糖基化模式。为了能在含有酸性缓冲液的收集样品瓶中直接对 mAb 进行还原,我们专门选择了 TCEP,因为它在宽泛的 pH 范围内具有还原能力。还原后的馏分在适用于生物分子的 Agilent PLRP-S 色谱柱(1000Å,2.1 x 12.5 mm)上进行脱盐处理后被输送到质谱系统。通过比较赫塞汀原研药的重链谱图以及两种高产量的克隆体谱图(图 3),我们可以看出,从定性的角度来看,这些产物是相似的,但它们的糖基化谱图所得的定量结果不同,即克隆体是低半乳糖化的。本例中所使用的液质联用系统由 Agilent 1290 Infinity 二元液相色谱与 Agilent 6545 超高分辨率精确质量数四极杆飞行时间质谱组成。
接下来可使用 Agilent Bio-Monolith Protein A 色谱柱来指导细胞培养物的优化,调节细胞培养介质以评估滴度的变化,从而将生物仿制药的糖基化特征控制在原研药物的性能指标范围内。例如,可以通过添加不同浓度的尿苷、半乳糖和氯化锰来实现优化。这些添加物是半乳糖基转移酶的基质和激活剂,正是这种酶促进了其他物质向 G0F 和 G1F 受体提供半乳糖残基。
安捷伦为您提供各种生物制药解决方案
为了您能够成功地将治疗药物推向市场,从疾病研究到 QA/QC 和生产过程的每个阶段,安捷伦都可以帮助您做出最正确的选择。不仅仅是因为我们设计出了可靠的仪器,能为您提供准确、可重复的结果,还源自于我们对生物制药工作流程有着深刻的理解,并据此为您提供一系列能无缝对接的产品作为研究、发现和开发的推动力,帮助候选生物药物不断向前发展。请立即联系安捷伦客户服务中心了解更多信息。
>> 更新资料 | 订阅 Access Agilent | 文章目录