세계보건기구(WHO)에 따르면 5명 중 1명이 일생 동안 암에 걸린다고 합니다.1 우려스러운 점은, 사망률을 보면 대략 남자의 경우, 아홉 명당 한 명, 여자의 경우, 12명 중 한 명이 이 병으로 사망합니다.1
1700년대 후반 이후 암 연구와 관련 분야에서 중요한 발견이 이루어지면서 암에 대한 이해와 질병 퇴치에 도움이 되는 현대적 분석법이 더욱 발전했습니다.2
지난 10년 동안 암 유전학, 암 관련 약물 및 백신, 면역요법 치료에서 굵직한 연구 성과들이 나왔습니다.
여기서는 애질런트 중개 연구 부문 책임자인 Mark Garner 박사가 환자에게서 암성 종양이 어떻게 발생하는지, 그리고 이를 퇴치하기 위한 연구 및 의학이 어떻게 발전하고 있는지에 대해 설명합니다.
돌연변이 질병으로서의 암
암은 하나 이상의 유전자 돌연변이에 의해 발생하며, 이러한 돌연변이는 세포 조절 메커니즘을 파괴하고 모든 암의 특징인 통제되지 않는 세포 증식을 직, 간접적으로 유도합니다. 이러한 돌연변이를 "운전자" 돌연변이라고 하며, 암세포가 축적하는 승객 돌연변이로 알려진 다른 수많은 돌연변이와 구별됩니다.
1970년대에 돌연변이가 일어났을 때 암 발병을 촉진하는 유전자를 식별함으로써 암의 돌연변이적 기초가 확립되었습니다. 이들 유전자는 "종양유전자"라고 불리며, 그 중 첫 번째는 조류에게 암을 유발하는 바이러스인 라우스육종(Rous Sarcoma) 바이러스에서 확인되었습니다.3 Varmus와 Bishop은 조류에서의 암을 유발하는 바이러스 유전자(src)를 확인한 후, src 유전자 유사체가 그들이 조사한 모든 조류 종에 자연적으로 존재한다는 사실을 보여주었습니다. 이 발견은 종양유전자가 세포 게놈의 정상적이고 필수적인 부분이며, 종양유전자에서의 돌연변이가 섬세한 균형을 유지하는 세포 항상성 메커니즘을 파괴한다는 것을 보여주었습니다.3

종양에 존재하는 돌연변이 또는 기타 유전체 파괴를 식별하는 것은 암 진단에서 필수적인 부분입니다. 암 유전체학 전문가와 기타 전문가로 구성된 분자 종양 위원회(MTB)는 환자 종양의 게놈 및 분자 데이터를 임상 관찰 결과와 통합하여 환자의 종양학자에게 가능한 치료 방법을 권장합니다.
MTB는 현재 많은 암 센터에서 표준 치료로 간주되고 있으며, "정밀 종양학"의 개념이 가장 명확하게 실현된 사례입니다. 즉, 발생 장기가 아닌 분자 표현형에 따라 환자의 종양을 표적으로 삼습니다.
정밀 종양학은 연구자와 임상의가 암에 접근하는 방식을 근본적으로 변화시켰습니다. 정밀 종양학의 개념과 가능성은 표적 치료, 특히 환자 종양의 상세한 분자 특성화에 기초한 표적 치료에 있으며, 기존의 화학요법보다 더 효과적이고 부작용이 적을 것으로 기대됩니다.
유전자 치료 외에 암 치료는 특정 유전자 그 자체를 표적으로 삼는 것이 아니라, 유전자의 단백질 산물, 신호 전달 경로의 다른 단백질, 심지어는 종양 돌연변이로 인해 변화가 많이 일어날 수 있는 저분자 대사체를 표적으로 삼습니다. 암 치료를 위한 효과적인 분자 표적을 식별하는 일은 연구자와 임상의가 직면하는 핵심적 과제인 경우가 많습니다.
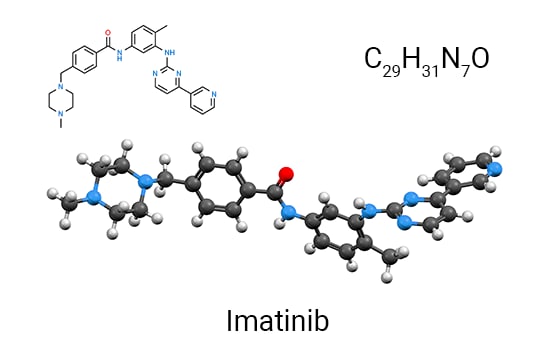
이러한 유전자-단백질-약물 패러다임의 전형적인 예는 만성 골수성 백혈병(CML)을 표적으로 하는 약물 "Gleevec"의 개발입니다. Gleevec 이전에는 CML 환자의 30%만이 진단을 받은 후 최대 5년까지 생존했습니다.4
1960년대 초, 대부분의 CML 환자들은 "필라델피아" 염색체로 알려진 비정상적으로 짧은 22번 염색체를 가지고 있다는 사실이 밝혀졌습니다. 처음에는 염색체의 끝이 삭제된 것으로 추정되었습니다. 그러나 1973년에 Janet Rowley는 세밀한 현미경 검사를 통해 22번 염색체의 빠진 부분이 사실은 전위였으며, "없어진" 부분이 9번 염색체의 끝에 붙었다는 사실을 밝혀냈습니다.5
분자 기술을 이용할 수 있게 되고 널리 보급되자 발전이 가속화되었습니다. 염색체 전위에 의해 예측된 DNA 재조합이 검증되었습니다. 재조합/전위 과정에서 무작위로 9번 염색체의 abl 유전자가 22번 염색체 끝에 있는 bcr 유전자의 세그먼트에 융합되는 것이 관찰되었습니다. 이 융합으로 bcr-abl이라는 새로운 유전자가 생성됩니다(그림 1에 강조 표시).
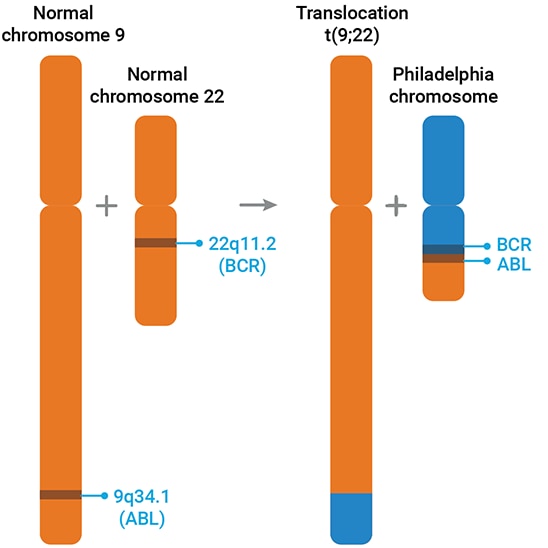
abl 유전자는 src 유전자의 세포 유사체와 비슷하며 티로신 키나아제 단백질을 코딩합니다. 대부분의 키나아제와 마찬가지로 이는 분열을 포함한 다양한 세포 과정을 조절하는 복잡한 신호 전달 경로 네트워크의 일부입니다. bcr의 일부를 abl에 융합하면 이러한 자가 조절이 방해를 받고, bcr-abl 티로신 키나아제의 과잉 활성이 세포 조절을 방해하여 CML로 이어집니다.
Brian Drucker 박사와 Nicholas Lyndon 박사가 이끄는 연구는 정상 세포 기능에 영향을 주지 않으면서 bcr-abl을 억제하는 화합물을 스크리닝하는 데 중점을 두었습니다. 유망 화합물 중 하나인 STI-571(Gleevec)이 임상 1상으로 진행되었습니다. 뉴욕 타임즈 인터뷰에서 Druker 박사는 "임상 시험을 하는 동안 우리는 기적을 목격했습니다. 환자들이 효과적인 용량에 도달하자 우리는 100%의 반응률을 얻었습니다"라고 말했습니다.6 마침내, Gleevec은 FDA의 승인을 얻었고, 그 이후로 매년 수천 명의 생명을 구했으며, 그 중에는 동일한 키나아제에 의해 유발되는 9가지 다른 형태의 암에 걸린 사람들도 포함되었습니다.
그러나 효과적인 암 약물 치료법의 발견이 항상 순탄하기만 한 것은 아닙니다. 예를 들어, AACR 2023 회의의 전체 회의 제목은 "KRAS를 이기다: 30년 만에 이룬 놀라운 성과"로, KRAS를 인간 종양 유전자로 확인한 후 K-RAS 단백질을 임상적으로 유용한 방식으로 표적화하는 데까지의 길고 어려운 과정을 함축하고 있습니다.7
면역 체계와 암: 포식자와 피식자, 우연과 필연
암 면역요법은 환자 자신의 면역 체계가 암세포의 "포식자" 역할을 할 수 있는 능력을 향상시키도록 설계되었습니다. 이는 포유류 면역 체계의 기본 기능인 면역 감시 개념을 기반으로 하는데, 자연 살해(NK) 및 선천성 면역 체계의 대식세포가 적응성 T 세포와 시너지 효과를 발휘한다는 것을 말합니다. 이 둘은 함께 암세포를 적극적으로 표적으로 삼아 파괴하는데, 가능한 한 종양이 형성되기 전 초기 단계에서 그러한 작용을 합니다.
그러나 암 면역치료의 표적은 찾기 힘든 먹잇감으로, 면역 체계를 숨기거나 심지어 무력화시키기 위해 주변 환경을 적응시킬 수 있습니다. 물론 암세포나 면역세포 모두 '생각'을 하거나 의도를 갖지 않습니다. 실제로 암세포는 자신이 겪은 모든 유전적 돌연변이를 가지고 있으며 계속해서 빠르게 분열하여 번성하면서 더 많은 무작위 돌연변이를 축적합니다. 이러한 돌연변이는 세포 대사와 상호 작용을 촉진하여 면역 체계를 회피하기 위한 환경을 적극적으로 형성합니다.
분자 생물학의 창시자 중 한 명인 Jacques Monod는 무작위적인 돌연변이 과정의 이러한 이분법과 면역 체계를 회피하기 위해 의도적인 변화로 보이는 과정을 거친다는 이론을 고찰했습니다. 철학 논문 '우연과 필연'(Chance and Necessity)에서 그는 둘 사이의 매개자가 "자연선택"이라고 설명했는데, 이 자연선택은 침묵하거나 무해한 돌연변이를 겪은 대부분의 유기체를 제거합니다.8
예를 들어, 암피실린에 민감한 대장균을 암피실린이 첨가된 일반적인 LB 한천배지에 도말하면 아무것도 자라지 않습니다. 그러나 몇 사이클을 통해 동일한 액체 배양을 성장시키고 도말을 반복하면 결국 일부 암피실린 내성 세포가 나타나기 시작합니다. 이러한 내성 세포는 "준비된 상태"가 아니었습니다. 암피실린에 민감한 대장균이 접시에 있는 항생제에 내성을 갖게 되는 데 필요한 돌연변이를 얻게 것은 무작위적인 돌연변이 과정을 통해서였습니다. 우연이자 필연인 것입니다. 매개자는 운이 좋은 몇 개의 세포를 "선택"하는 자연선택입니다. 이것은 유기체가 특성을 획득하기 위해 의식적이고 의도적으로 선택하는 것과 유사해 보일 수 있지만 무작위 선택에 기초합니다.
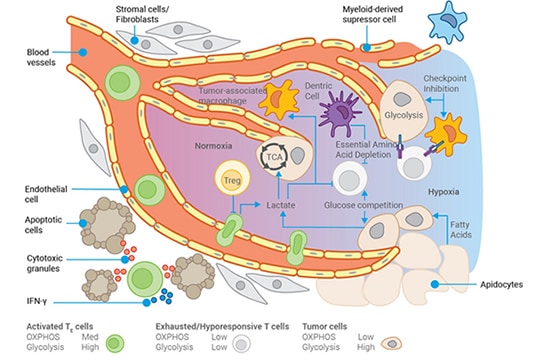
종양에서도 비슷한 과정이 일어납니다. 암세포에 의한 돌연변이 축적이 가져오는 결과 중 하나는 종양 세포의 빠른 증식을 유지하기 위해 거대분자의 전구체를 생성하는 데 필요한 세포 대사가 장애를 일으키는 것입니다. 종양 세포는 거의 모든 탄소원을 사용하여 대사를 촉진할 수 있으며, 심지어 RNA를 분해하여 연료를 공급하기도 합니다. 이러한 변화는 종양 미세 환경(TME)으로 알려진 종양 주변의 세포 외 환경에 영향을 미칩니다.
종양 세포는 TME의 거의 모든 포도당을 소비할 수 있으므로 침윤하는 T 세포는 지질을 연료로 사용할 수밖에 없습니다. 지질의 유형에 따라 이는 항암 활성을 약화시킬 수 있습니다. TME는 종양의 빠른 성장을 뒷받침하는 혈관이 부족하다는 점 때문에 더 산성화되고 산소 함량이 낮아집니다.
TME는 종양 세포를 찾아 파괴하는 면역 체계의 능력을 약화시키는 독성 폐기물 처리장에 비견할 수 있습니다. 마치 종양 세포가 TME를 변화시킴으로써 본능적으로 스스로를 보호하는 것과 같습니다.
또한 종양은 정상 세포와 마찬가지로 섬유아세포를 끌어들여 콜라겐을 배설하고 비정상적인 세포 외 기질을 형성하지만 암세포도 기질을 생성합니다. 역설적이게도, 종양 미세 환경이 면역 세포로 가득 차 있음에도 불구하고 이러한 면역 세포는 효과적인 포식자로서 행동하는 자신의 능력을 줄이거나 없애버렸습니다. 그 결과, 등잔 밑에 숨어 있는 먹이는 또 다른 하루를 위해 살아남습니다.
유효 슈팅

T 세포는 세포 표면에 나타난 펩타이드 조각(항원)을 조사하여 세포를 암으로 인식합니다. 발달 단계에서 T 세포는 사람의 모든 "고유" 단백질에서 항원을 인식하는 법을 배웁니다. T 세포가 이전에 알려지지 않은 항원(새로운 항원 또는 "신생항원")을 가진 세포를 발견하면, T 세포는 그 세포를 외래, 암성 또는 감염 세포로 인식하고(이와 동일한 메커니즘으로 바이러스 감염 세포를 식별함) 세포 사멸을 시작합니다.
최근에는 높은 돌연변이 부담을 가진 종양일수록 면역 체계에 더 많은 신생항원을 제공해야 한다는 사실이 밝혀졌습니다. 돌연변이 부담이 큰 종양 환자가 돌연변이가 적은 종양 환자보다 면역 치료에 더 잘 반응하는 경우가 있습니다. 이를 해석하면, 돌연변이의 수가 많을수록 신생항원의 수가 많아지고, 무작위 T 세포가 신생항원 중 하나를 인식하고 종양 세포를 표적으로 삼을 가능성이 높아집니다. 아주 적절한 비유로, 면역 체계가 "더 많은 유효 슈팅"을 하여 암을 제거할 가능성이 더 높다고 말할 수 있습니다.
2020년, 미국 FDA는 항-PD-1 약물인 pembrolizumab(Keytruda)을 메가베이스당 10개 이상의 돌연변이 부담을 가진 모든 고형 종양에 사용할 수 있도록 승인했습니다. 후속 연구에서 모든 종양 유형에 대한 단일 컷오프가 최적인지에 대해 의문을 제기했지만, 고도로 돌연변이된 종양이 면역 체계에 더 취약하다는 원칙은 분명합니다. 종양에 더 많은 돌연변이를 유도하여 면역 체계에 더 취약하게 만들자는 도발적인 제안이 있기까지 합니다. 많은 사람들이 여전히 이것을 급진적인 접근으로 생각하지만, 우리는 암을 만드는 돌연변이를 파괴하기 위해 이를 우리에게 유리하게 효과적이고 안전하게 사용하는 방법을 알아가고 있습니다. 손자가 "전쟁의 기술"에서 말했듯이, "패배로부터 우리 자신을 지키는 것은 우리 자신의 손에 달려 있지만, 적을 물리칠 기회는 적 자신이 주는 것이다."10
Mark Garner 박사 소개

Mark Garner는 미시간 주립대학교에서 생화학 박사 학위를 받았습니다. 대학원 연구의 일환으로 그는 단백질-DNA 상호 작용 연구를 위해 현재 보편적으로 사용되는 겔-시프트 또는 "EMSA" 어세이를 개발했습니다. 그 후 그는 미국 암 협회에서 박사후 연구원으로 있었고, NIH에서 국가 연구 서비스 상을 수상했으며, 위스콘신-매디슨 대학에서 두 번째 박사후 연구를 진행했습니다. 이 기간 동안 Mark는 괴팅겐에 있는 Max Planck Institut für Biophysikalische Chemie와 장기적인 관계를 발전시켰습니다. 그 후 NIH로 돌아와 핵산의 모세관 전기영동, 거대분자 군집의 분자 생물리학 및 이것이 세포 과정에 미치는 영향에 대한 기초 연구를 수행했습니다. 민간 부문에 진출한 후 그는 여러 첨단 기업에서 핵심 구성원으로 활동하고 있습니다. 2006년 Mark는 캐나다 토론토로 이주하여 현재 거주하고 있습니다. 그는 2020년 초에 애질런트 테크놀로지스에 합류했으며 현재 애질런트의 중개 연구 마케팅 부문 책임자입니다.
참고 자료
1 Global cancer burden growing, amidst mounting need for services (who.int) 2 Milestones in Cancer Research and Discovery - NCI 3 Varmus, H.E. Viruses, genes, and cancer. I. The discovery of cellular oncogenes and their role in neoplasia. Cancer 55, 2234-2238 (1985) 4 Pray, L. (2008) Gleevec: the Breakthrough in Cancer Treatment. Nature Education 1(1):37 5 ROWLEY, J. A New Consistent Chromosomal Abnormality in Chronic Myelogenous Leukaemia identified by Quinacrine Fluorescence and Giemsa Staining. Nature 243, 290–293 (1973). 6 Researcher Behind the Drug Gleevec - The New York Times (nytimes.com) 7 AACR Annual Meeting 2023: Beating KRAS - American Association for Cancer Research (AACR) 8 Monod, Jacques. Chance and necessity : an essay on the natural philosophy of modern biology. London, Penguin, 1997. 9 Marcus et al FDA Approval Summary: Pembrolizumab for the treatment of tumor mutational burden-high solid tumors Clin Cancer Res 27, 4685-4689 (2021) 10 Tzu, Sun. The Art of War. United States, Shambhala, 2019.