분석 장비의 적격성 평가를 위한 데이터 무결성 보증

애질런트 CrossLab 규제준수 서비스로 감사 및 규제 점검 관련 위험을 방지하십시오
의약품 실험실 또는 규제 요건을 준수해야 하는 모든 실험실은 사용하는 분석 기기의 적합성을 입증하고 문서화해야 합니다. 실험실은 분석 기기 적격성 평가(AIQ)를 수행함으로써 이와 같은 요건을 충족시킬 수 있습니다.
미국 약전은 전문적으로 AIQ: USP <1058> 일반 챕터를 구성해 기기 적격성 평가를 기술하고 있는 유일한 약전입니다. 따라서 USP <1058>의 변경에 따라 적응하는 것은 글로벌 환경에서 매우 중요한 일입니다. USP <1058>의 2017년 버전은 2017년 8월 1일부터 발효되었으며, 귀하의 실험실에서 아주 중요하게 인식해야 할 핵심 규제 관련 서류입니다.
애질런트는 귀하의 SOP가 2017년 USP <1058> 규제 요건을 비용 효율적으로 충족시켜 통합적이고 라이프 사이클 접근법으로 AIQ를 수행할 수 있도록 도움을 드립니다.
2017년 USP <1058>에 대해 알아야 하는 것
2017년 USP <1058> 기기 적격성 평가에 대한 라이프 사이클 접근법: 실험실 감사 통과를 위한 최선의 선택
기기 적격성 평가 - 라이프 사이클 접근법
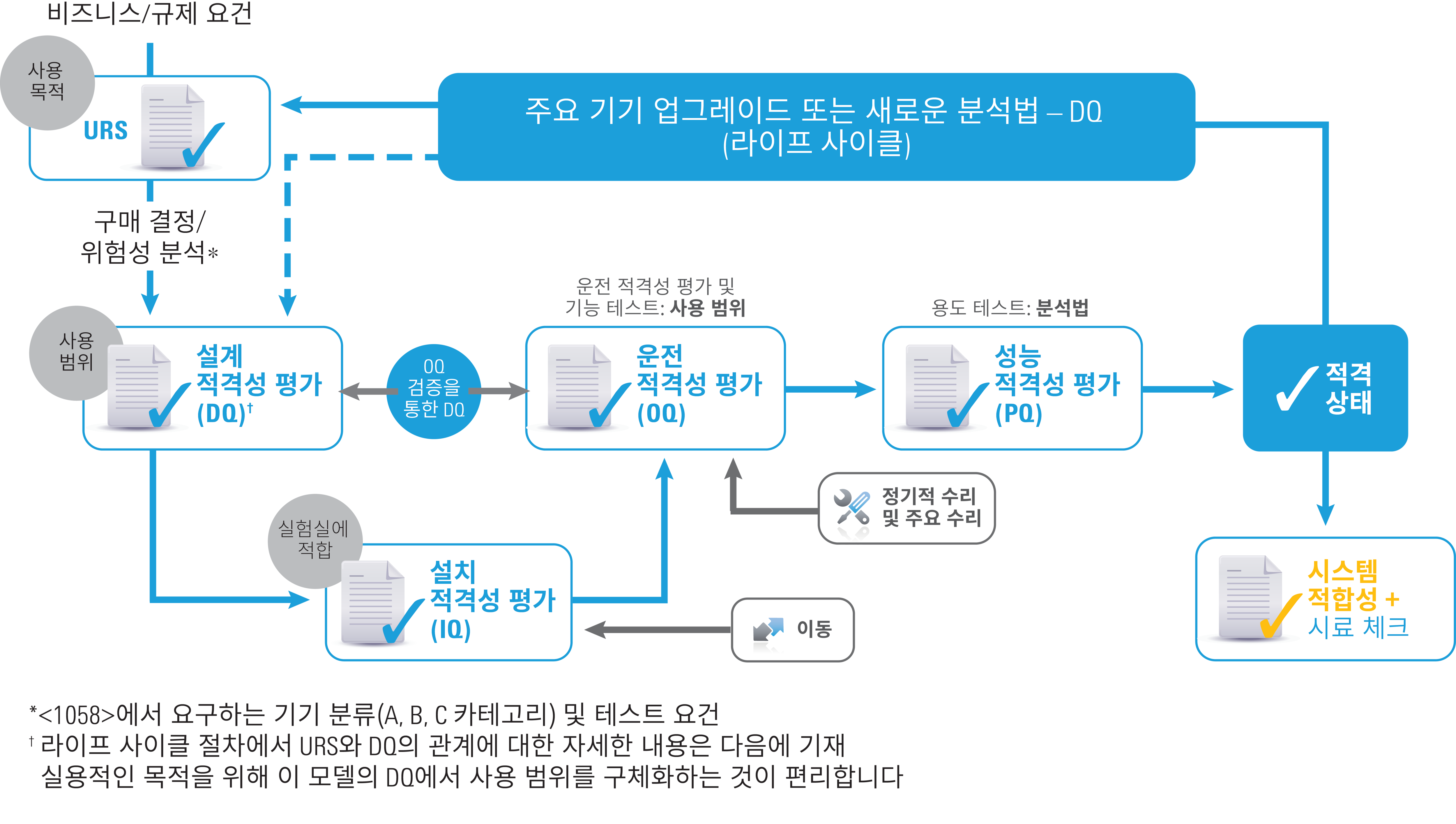
기기 적격성 평가 라이프 사이클
개정된 2017년 USP <1058>에는 전체 기기 라이프 사이클을 포함시키기 위한 AIQ의 역사가 반영되어 있습니다. 가이드라인 중 일부인 다음과 같은 항목은 그대로 유지되었습니다.
- 기기 그룹 A, B, C(예시는 삭제됨)
- "4Q": 설계 적격성 평가(DQ), 설치 적격성 평가(IQ), 운전 적격성 평가(OQ), 성능 적격성 평가(PQ)
그러나 4Q에는 각각 목적에 따라 분명한 차이가 있으며, 각 적격성 평가간 관계에도 중요한 차이가 있습니다. 또한 소프트웨어 섹션이 현저하게 확장되었습니다.
가장 중요한 변화로는 다음과 같은 것들이 있습니다.
- URS(사용자 요구 사양, User Requirement Specification)의 필수화
- OQ 테스트는 이제 URS/DQ와 연동
- OQ(기능 및 사용 범위)의 필수화
- PQ(사용/응용 목적)의 필수화
- DQ, OQ, PQ는 이제 기기 용도와 동적으로 연계
변화 사항이 의미하는 것:
귀하의 분석 기기 라이프 사이클과 연관된 현재의 정책 및 절차는 2017 USP <1058>을 충족시키지 못할 수 있으므로 업데이트가 필요합니다.
애질런트 CrossLab 규제준수 컨설턴트는 귀하의 실험실이 2017 USP <1058> 요건에 맞는 적격성 평가 절차를 적용할 수 있도록 도와드립니다.
소프트웨어 검증 및 기기 적격성 평가 사이의 통합적인 접근 USP <1058>와 GAMP 요건 충족®
적격성 평가의 지속성

* 적격성 평가 라이프 사이클의 특정 Requirements Trace Matrix를 포함하는 요건은 사용 목적, 기기 복잡성에 따라 달라지며, 회사 정책 GAMP는 ISPE의 등록 상표입니다. GAMP 발행물을 보시려면 ISPE 웹사이트를 참고하십시오. www.ispe.org/publications/guidance-documents
하드웨어 적격성 평가 및 소프트웨어 검증 사이의 통합적인 접근
소프트웨어 요건의 현저한 확장과 그룹 A, B, C 해당 기기 사례 삭제는 USP <1058>이 이제 GAMP® 5와 더 긴밀하게 연계된다는 것을 의미합니다.
역사적으로 USP <1058>은 그룹 A와 B 기기를 규제 대상 실험실에 도입하는 과정을 간소화해왔습니다. 2017년의 업데이트는 이러한 이점을 그룹 C의 일부 기기들에까지 확장 적용합니다.
그러나 2017 USP <1058> 요건은 각 기기의 소속 카테고리를 파악하기 위한 위험성 평가를 구체화하고 있습니다. 이에 따라 실험실에서는 보유 기기가 어떤 카테고리에 속하는지를 증명하고 기기 사용 목적에 따라 지속적으로 카테고리 분류를 관리하는 절차를 업데이트해야 합니다.
이러한 변화는 2017 USP <1058>이 이제 실험실 컴퓨터 시스템을 위한 GAMP 우수 실험실 가이드(GPG)(ISBN 978-1-936379-49-1) 및 GAMP 5(ISBN 1-931879-61-3)와 연계되는 적격성 평가의 연속 절차 중 일부로 간주될 수 있음을 뜻합니다. 세부 적용 사항:
- 일반 기기(예: HPLC, GC)에는 USP <1058> 사용
- 복잡한 기기(예: QTOF)에는 GAMP GPG 사용
- Bespoke 소프트웨어 검증에는 GAMP 5 사용
변화 사항이 의미하는 것:
실험실이 규제준수 요건을 충족하도록 하려면 귀하의 AIQ를 2017 USP <1058>에 맞게 조정해야 합니다. 여기에는 모든 관련 SOP와 AIQ 라이프 사이클 정책 서류가 포함됩니다.
애질런트 CrossLab 규제준수 컨설턴트가 귀하의 컴퓨터 시스템 검증(CSV) 위험을 분석하고 시스템과 소프트웨어의 적용/검증을 도와드립니다.
분석 실험실의 데이터 통제: 완전한
데이터 무결성을 위한 기초
적격성 평가 및 데이터 무결성
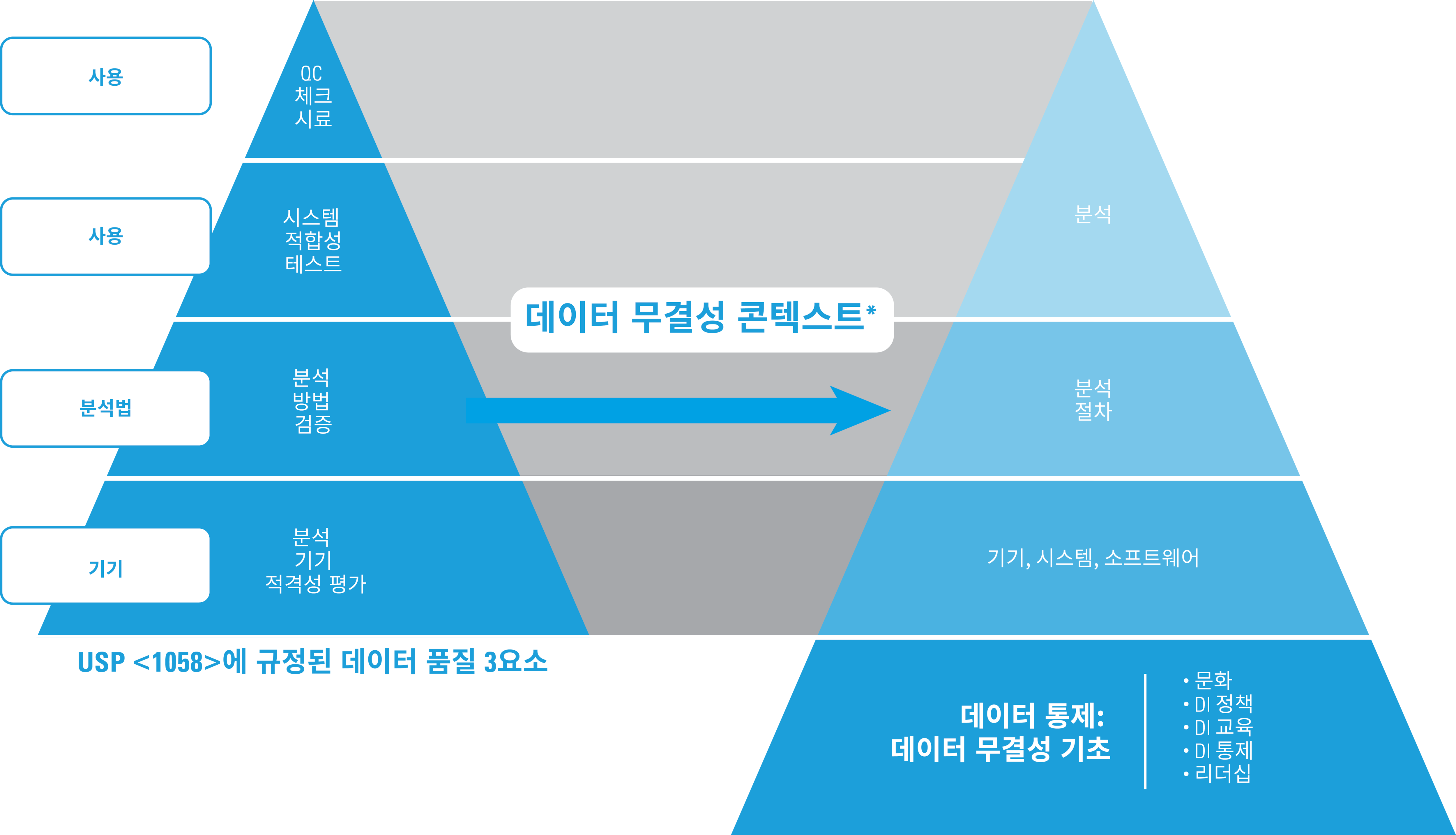
* 허락 하에 ISBN 978-1-84973-662-6에서 발췌
데이터 무결성의 중요성
데이터 위반과 관련된 규제 감사 발견 사항은 전 세계의 규제 기관으로 하여금 데이터 무결성을 상세히 살펴보도록 하고 있습니다. 이는 다른 말로 하면 여태까지는 데이터 무결성에 대한 관심이 AIQ와 같은 전통적인 감사 초점 분야에 비해 덜했다는 뜻이기도 합니다. 그러나 최근의 FDA 483에 의하면 규제 기관들은 데이터 무결성, 추적성, AIQ 보고서의 기술적 내용을 세부적으로 자세히 살펴보기 시작했습니다.
2017 USP <1058>에 기재된 데이터 품질 3요소는 종전의 내용에서 변화가 없으나, 데이터 무결성 관점에서 이 3요소는 다음과 같은 모델로 확장되었습니다. 특히 다음과 같은 부분이 중요합니다.
- USP <1058> 데이터 품질 3요소의 기초 - AIQ
- 반복 작업 또는 재실행은 적절한 관리, 설명(서면 기록)이 필요
- 필수 요건으로서의 데이터 추적성
- 데이터 통제는 이제 모든 품질 데이터의 기초
변화 사항이 의미하는 것:
데이터 무결성 문제는 규제가 더 까다로워짐을 의미합니다. 결과의 설공적인 보호를 위해서는, 데이터의 결함이 없는 완전함을 증명할 수 있도록 준비해야 합니다.
애질런트 CrossLab 규제준수 컨설턴트는 컴퓨터 시스템 검증(CSV) 서비스를 제공하는 것에 더해 귀하의 데이터 무결성 갭 분석 및 분석법 검증 수행을 돕습니다.