規制査察に対する分析機器のデータインテグリティの確保

Agilent CrossLab コンプライアンスサービス:
監査と規制査察に伴うリスクを最小化
製薬ラボをはじめ、分析結果に規制項目が適用されるラボには、分析機器の使用用途への適格性を立証し、文書化することが義務付けられています。そのための手段として用いられているのが、分析機器適格性評価 (AIQ) です。
米国薬局方の USP 総則 <1058> は、AIQ について規定する唯一の主要薬局方であることから、その改訂は世界的に大きな意味を持ちます。2017 年 8 月 1 日に発効された 2017 年版 USP <1058> は、ラボにとってきわめて重要な規制文書となっています。
アジレントの AIQ ソリューションは、ライフサイクルに基づく統合型アプローチです。適格性評価プロセスをコスト効率よく導入し、2017 USP <1058> の要件に適合した SOP を確立することができます。
2017 USP <1058> への多角的なアプローチ
2017 USP <1058> 機器適格性評価へのライフサイクルアプローチ: 監査に万全に備えるための最善の方法
機器適格性評価 — ライフサイクルアプローチ
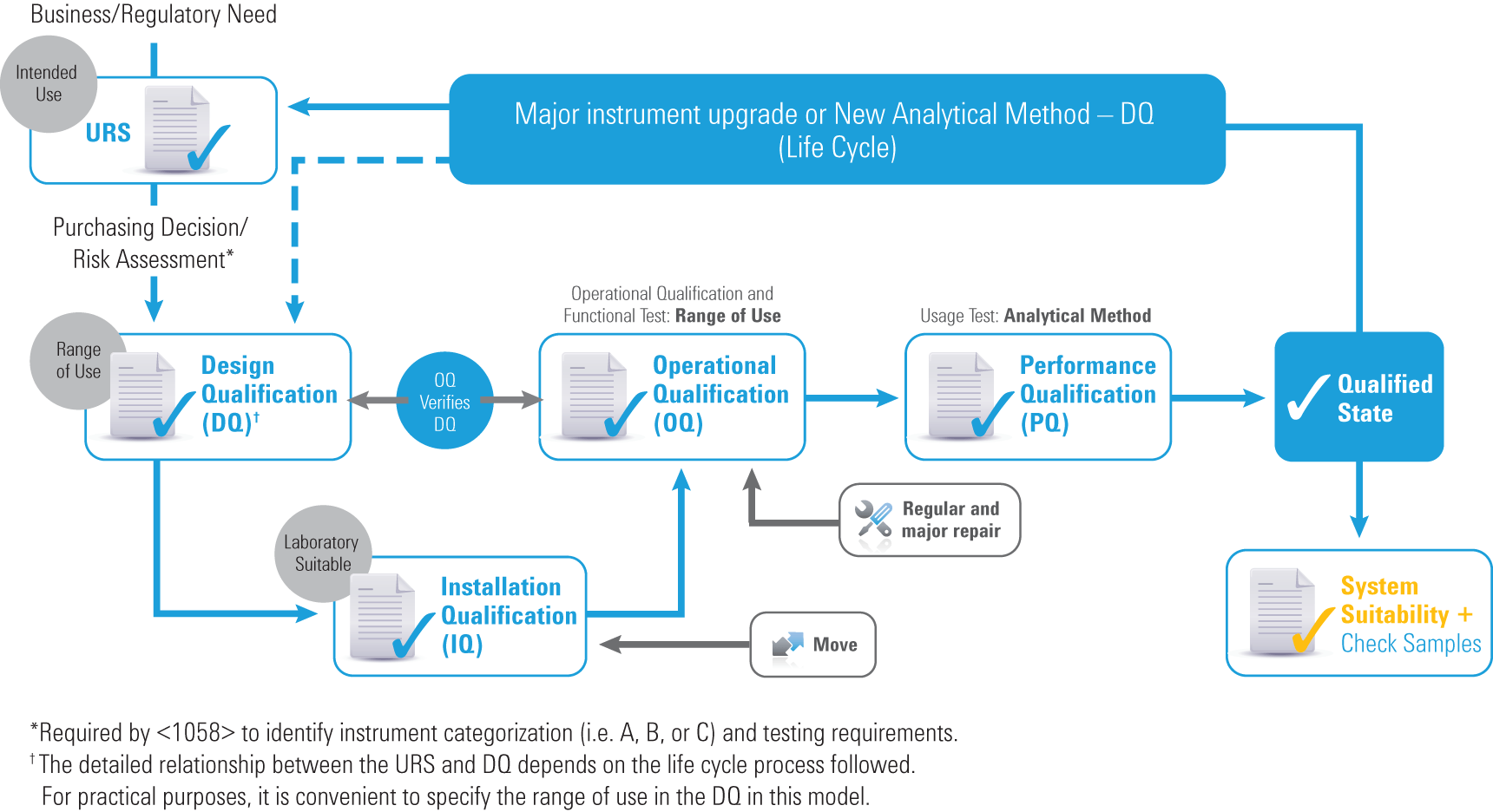
機器適格性評価のライフサイクル
改訂版 2017 USP <1058> では、機器のライフサイクル全体がカバーされるよう AIQ が強化されています。次を含む一部のガイドラインは従来と同じです。
- 機器グループ A、B、C (ただし、例は削除)
- 「4Q」: 設計時適格性評価 (DQ)、据付時適格性評価 (IQ)、稼動時適格性評価 (OQ)、稼動性能適格性評価 (PQ)
一方、改訂版では、4Q の役割とその相互関係が詳細に明確化されており、ソフトウェアに関するセクションも大幅に拡充されています。
重要な変更点は次のとおりです。
- URS (ユーザー要求仕様書) が必須になりました。
- OQ 試験が URS/DQ に「関連付け」られました。
- OQ (機能および使用範囲) が必須になりました。
- PQ (用途/アプリケーション) が必須になりました。
- DQ、OQ、PQ が機器の使用に応じて動的に調整されるようになりました。
ラボへの影響:
分析機器のライフサイクルに関連する既存のポリシーと手順が、2017 USP <1058> に全面的に適合していない場合は更新が必要です。
Agilent CrossLab コンプライアンスコンサルタントが、2017 USP <1058> に適合した適格性評価プロセスの導入をサポートします。
ソフトウェアバリデーションと機器適格性評価に対応した統合型アプローチ: USP <1058> と GAMP の連係®
一連の適格性評価

* 適格性評価ライフサイクルの要件トレースマトリックスに必要となる項目は、用途、機器の複雑さ、企業のポリシーによって異なります。GAMP は ISPE の登録商標です。GAMP に関する出版物については、ISPE の Web サイト (www.ispe.org/publications/guidance-documents) をご覧ください。
ハードウェア適格性評価とソフトウェアバリデーションへの統合型アプローチ
ソフトウェア要件が大幅に拡充され、機器グループ A、B、C の例が削除されたことで、USP <1058> は GAMP® 5 とより調和した内容になっています。
これまでの USP <1058> では、規制対象ラボへのグループ A および B 機器の導入プロセスが簡素化されていました。2017 年の改訂により、この利点を一部のグループ C 機器でも得られるようになりました。
ただし、2017 USP <1058> の要件では、リスク評価において各機器のカテゴリを明確にすることが定められています。ラボは機器のカテゴリが妥当であることを立証し、機器の使用に基づいて矛盾なくカテゴリ化できるよう手順を更新する必要があります。
これらの変更点により、2017 USP <1058> と、ラボのコンピュータシステムに関する GAMP 実践規範ガイド (GPG) (ISBN 978-1-936379-49-1) および GAMP 5 (ISBN 1-931879-61-3) を一連の適格性評価オプションと見なすことができるようになりました。具体的には次のとおりです。
- 標準的な機器 (HPLC、GC など) には USP <1058> を使用
- 複雑な機器 (QTOF など) には GAMP GPG を使用
- カスタムソフトウェアのバリデーションには GAMP 5 を使用
ラボへの影響:
コンプライアンスを確保するには、2017 USP <1058> に沿った AIQ が必要です。これには、関連するすべての SOP および AIQ ライフサイクルポリシー文書も含まれます。
Agilent CrossLab コンプライアンスコンサルタントが、コンピュータシステムバリデーション (CSV) のリスク評価と、システムおよびソフトウェアの実装/バリデーションをサポートします。
分析ラボにおけるデータ管理: 確固たるデータインテグリティの
基盤
適格性評価とデータインテグリティ
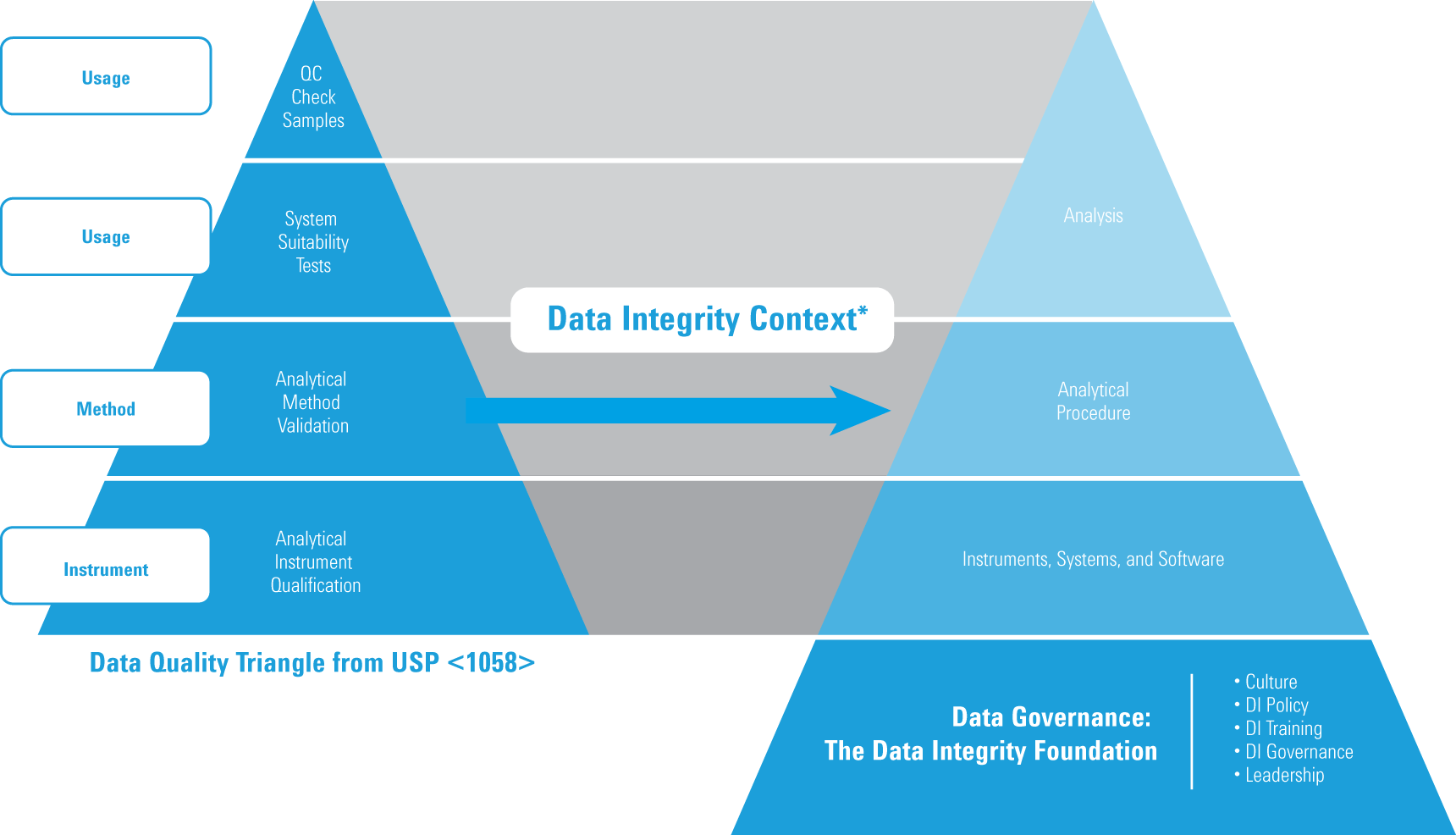
* ISBN 978-1-84973-662-6 より許可のもと編集
データインテグリティの重要性
規制当局の監査でデータ違反に関連する問題が表面化したことで、データインテグリティに対する世界中の規制機関の目は厳しさを増しています。一時は、監査で従来重視されてきた AIQ などへの手が緩められていましたが、最近発行された FDA 483 は、規制機関が再び、データインテグリティ、トレーサビリティ、AIQ レポートの技術的内容を詳細に調査し始めていることを示しています。
データ品質トライアングルは 2017 USP <1058> でも変わっていませんが、データインテグリティの観点から見ると、上図に示すモデルへと進化しています。具体的には次のとおりです。
- AIQ が USP <1058> データ品質トライアングルの基盤になります。
- 反復作業や再分析を管理し、説明 (文書化) する必要があります。
- データのトレーサビリティが重要な要件になりました。
- データ管理があらゆる品質データの基盤になりました。
ラボへの影響:
データインテグリティの問題が発生すれば、これまで以上に多くの規制措置がとられることになるでしょう。結果の正当性を立証するためには、データインテグリティが損なわれていないことを証明するための準備が必要です。
Agilent CrossLab コンプライアンスコンサルタントが、コンピュータシステムバリデーション (CSV) サービスの提供に加え、データインテグリティのギャップ分析とメソッドバリデーションをサポートします。